Quantitative Analysemethoden
Quantitative Analysen, wie unterschiedliche Titrationen und die Gravimetrie, identifizieren die Stoffmenge eines Stoffes in einer Probe, können aber nicht identifizieren welcher Stoff vorliegt.
Beliebteste Videos
Jetzt mit Spaß die Noten verbessern
und sofort Zugriff auf alle Inhalte erhalten!
30 Tage kostenlos testenInhaltsverzeichnis zum Thema
Definition quantitative Analysemethoden
Die quantitative Analyse ist ein Teilbereich der analytischen Chemie. Dabei geht es um die mengenmäßige Bestimmung eines Stoffes in einer Probe. Diese Proben sind Stoffgemische. Im Gegensatz dazu ist die Bestimmung der enthaltenen Stoffe Aufgabe der qualitativen Analyse. An einer Probe können aber auch qualitative und quantitative Analysen durchgeführt werden.

Die quantitative Analyse ist besonders wichtig bei der Qualitätssicherung im produzierenden Gewerbe. So wird getestet, ob Medikamente oder Rohstoffe in der richtigen Konzentration hergestellt wurden. Auch in der Umweltchemie spielt sie eine große Rolle. So kann festgestellt werden, ob Böden oder Gewässer zu stark mit bestimmten Stoffen, wie Nitraten und Phosphaten durch Düngemittel, belastet sind.
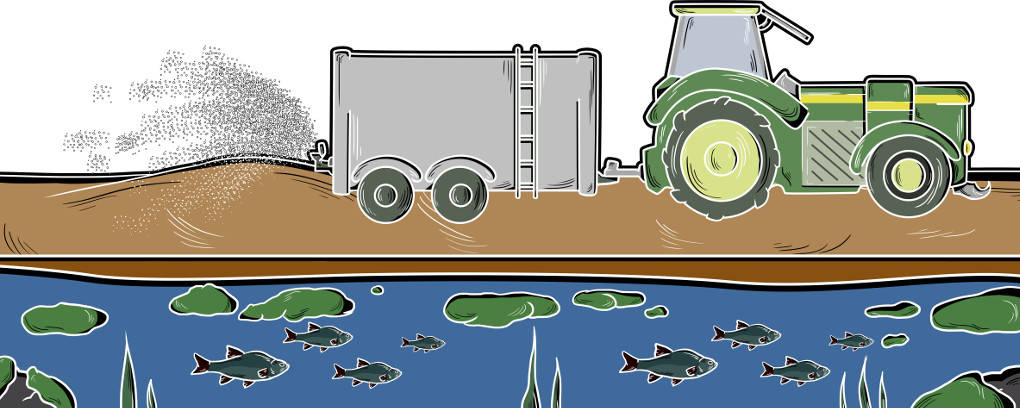
Es gibt verschiedene Methoden, eine quantitative Analyse durchzuführen. Sie werden in zwei große Gruppen unterschieden. Es gibt die klassischen Methoden. Diese nutzen chemische Reaktionen, um den Gehalt eines Stoffes zu bestimmen. Dazu zählen Fällungs- und Redoxtitrationen, Gravimetrie und Komplexometrie. Die zweite Gruppe ist die der physikalischen Methoden wie die Konduktometrie, die die Leitfähigkeit der Lösung untersucht, und die Potentiometrie, welche das sich bildende elektrochemische Potential zur Bestimmung nutzt.
Titrationen
Mengenbestimmungen in der Chemie werden zumeist mithilfe von Titrationen durchgeführt. Dazu benötigt man eine Bürette, die die Maßlösung mit bekannter Konzentration enthält, und ein Gefäß mit der Probe (Analysenlösung).
Die Maßlösung wird tropfenweise dazugegeben. Am Äquivalenzpunkt wurde die zu untersuchende Substanz vollständig umgesetzt. So kann bei Kenntnis der Reaktionsgleichung und dem zugeführten Volumen der Maßlösung die Konzentration der Analysenlösung bestimmt werden. Nach diesem Prinzip laufen alle Titrationen ab.
Bei der Redoxtitration nutzt man Redoxreaktionen, um die zu analysierende Substanz umzusetzen. Dies geschieht z.B. bei der Iodo- und der Manganometrie. Während der Reaktion wird die farbige Maßlösung immer wieder entfärbt. Am Endpunkt der Titration bleibt die Farbe bestehen, da keine Reaktion mehr stattfinden kann. So kann das Ende der Titration gut erkannt werden. Auch eine Bestimmung des Endpunkts mithilfe eines Indikators oder einer potentiometrischen Messung (Potentiometrie) ist möglich.
Die Fällungstitration ist eine weitere Methode der quantitativen Bestimmung. Man macht sich hier Fällungsreaktionen zunutze. Dabei entstehen aus Ionen schwerlösliche Salze, wie z.B. Silberhalogenide $(AgCl,~ AgBr,~AgI)$. Sobald kein weiterer Niederschlag mehr ausfällt, ist der Endpunkt erreicht. Dieser kann auch durch eine Leitfähigkeitsmessung (Konduktometrie) bestimmt werden. Bei dieser wird im Verlauf der Reaktion die Leitfähigkeit der Analysenlösung gemessen und in einem Diagramm abgetragen. Da im Laufe der Reaktion immer weniger Ionen in der Lösung vorhanden sind, fällt die Leitfähigkeit. Ist kein Analyt mehr vorhanden, weil er vollständig umgesetzt ist, erhöht sich die Zahl der Ionen bei Zugabe der Maßlösung wieder und die Leitfähigkeit steigt an. So kann der Endpunkt erkannt werden.
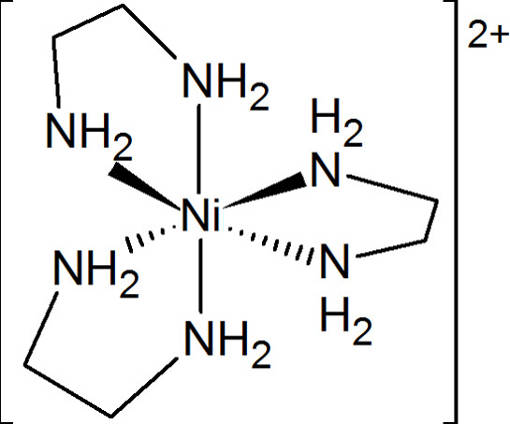
Auch bei der Komplexometrie handelt es sich um eine Titration zur Mengenbestimmung eines Stoffes. Dazu nutzt man Komplexbildungsreaktionen, da diese z.B. Metall-Ionen sehr gut und stabil binden können.
Gravimetrie
Die Gravimetrie ist eine sehr genaue, aber auch aufwendige Methode zur quantitativen Bestimmung. Sie beruht auf dem Auswägen des gesuchten Stoffes (Analyt). Dazu wird z.B. der Analyt ausgefällt und abfiltriert. Wichtig dabei ist, dass das Fällungsprodukt in seiner Zusammensetzung genau bekannt ist und sich nicht aus mehreren Verbindungen zusammensetzt. Es kann mit einem Glas- oder Porzellanfiltertiegel oder einem Filterpapier abfiltriert werden. Der Papierfilter muss dann aber vollständig verbrannt werden, damit er das Wägeergebnis nicht verfälscht. Das geschieht in einem sogenannten Muffelofen. Das Filtrat muss absolut trocken sein, da auch Kristallwasser das Ergebnis verfälscht. Daher muss es in einem Trockenschrank getrocknet und danach in einem Exikator trocken abgekühlt werden. Das Ergebnis der Analysenwaage (vier Nachkommastellen) wird dann aufgenommen, wenn die Masse konstant angezeigt wird. Anschließend muss noch der prozentuale Anteil des gesuchten Stoffes aus der Fällungsform berechnet werden, um den letztendlichen Anteil in der Probe zu bestimmen.
Alle Videos zum Thema
Videos zum Thema
Quantitative Analysemethoden (6 Videos)
Alle Arbeitsblätter zum Thema
Arbeitsblätter zum Thema
Quantitative Analysemethoden (6 Arbeitsblätter)
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- Fraktionierte Destillation Von Erdöl
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung
- Fermentation












 Komplexometrie
Komplexometrie
 Redoxtitration
Redoxtitration
 Fällungstitration
Fällungstitration
 Gravimetrie
Gravimetrie
 Potentiometrie
Potentiometrie
 Konduktometrie
Konduktometrie












