Waschmittel
Tenside sind die Zauberwaffe der Reinigung. Sie lösen Schmutz und Fett von Wäsche, Geschirr und Haut.
Beliebteste Videos
Jetzt mit Spaß die Noten verbessern
und sofort Zugriff auf alle Inhalte erhalten!
30 Tage kostenlos testenInhaltsverzeichnis zum Thema
Tenside im Alltag
In unserem Alltag müssen wir immer irgendetwas reinigen, ob nun unsere Hände, das Geschirr in der Küche oder die Wäsche. Hierbei sind Tenside ein unverzichtbarer Helfer.

Tenside ermöglichen es, dass sich Substanzen, die eigentlich nicht miteinander mischbar sind, zu einer Dispersion verbinden. Dabei bewirken Tenside eine Absenkung der Oberflächenspannung des Lösemittels, in dem sie sich befinden. Zwischen 2 Phasen, z.B. Fett und Wasser, verringern sie die Grenzflächenspannung. Tenside werden vor allem in Seifen, Waschmitteln, Reinigungsmitteln und Körperpflegeprodukten eingesetzt. Auch in Lebensmitteln kommen sie zum Einsatz. Hier werden sie als Emulgatoren bezeichnet.

Wie kommt diese Wirkungsweise der Tenside zustande? Das lässt sich anhand des molekularen Aufbaus erklären. Ein Tensid kannst du dir wie einen Lolly vorstellen. Der Kopf des Tensids ist der polare Teil. Dieser Teil kann mit Wasser wechselwirken, da es ebenfalls polar ist. Der Kopf ist daher hydrophil, d.h. wasserliebend. Der restliche Teil des Tensids, der Stiel, ist unpolar. Dieser unpolare Teil wechselwirkt mit anderen unpolaren Stoffen wie Fett oder Benzin. Der Schwanz ist daher hydrophob, d.h. wasserabweisend, oder auch lipophil, d.h. fettliebend.
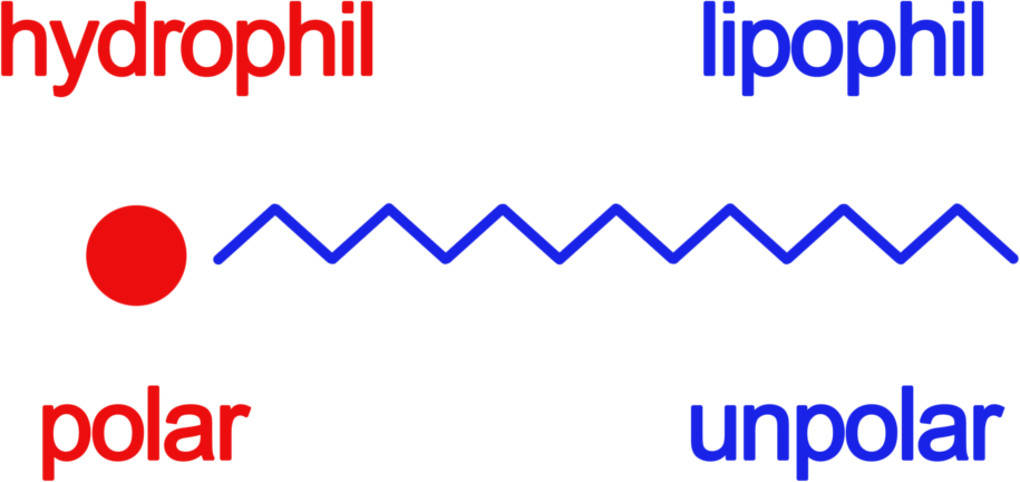
Ein Beispiel für ein solches Tensid ist das Säurerest-Ion einer Fettsäure, diese entstehen durch Verseifung des Fettsäureesters. Hierbei werden die Protonen der Säuren mit Metallkationen substituiert. In Lösung entstehen dann Carboxylat-Ionen und Metallkationen. Das Carboxylat-Ion trägt eine negative Ladung und ist damit sehr polar. Der restliche Stiel des Moleküls besteht nur aus Kohlenstoff und Wasserstoff und ist somit gänzlich unpolar.
Waschwirkung
Auf welche Weise ein Tensid nun Schmutz lösen kann, erkläre ich dir jetzt. Zum Waschen setzen wir zumeist Wasser ein. Du hast aber bestimmt schon oft festgestellt, dass man einiges an Schmutz nicht allein mit Wasser beseitigen kann. Das liegt an der Polarität der Stoffe.
Allgemein gilt „Gleiches löst sich in Gleichem“. Wasser ist ein sehr polares Lösemittel. Polare Stoffe wie Salze lassen sich meist sehr gut in Wasser lösen. Unpolare Stoffe wie Fette und Öle sind aber fast wasserunlöslich. Um diese zu entfernen, können die Tenside helfen. Sie fungieren quasi als Vermittler zwischen den polaren und den unpolaren Stoffen. Das unpolare Schmutzteilchen kann mit dem unpolaren Schwanz der Tenside in Wechselwirkung treten. Es wird von den Tensiden vollständig eingehüllt.

Die polaren Köpfe der Tenside zeigen nach außen. Hier können sich nun Wassermoleküle anlagern und eine Hydrathülle bilden. Damit wird das gesamte Schmutzteilchen hydratisiert, d.h. gelöst. Es liegt nun eine Dispersion vor. Das bedeutet der Schmutz ist fein verteilt im Wasser. Da es keine echte Lösung ist, erscheint die Dispersion trüb und lichtundurchlässig.
Vor- und Nachteile von Waschmitteln
Tenside bringen große Vorteile und werden in großem Maßstab zur Reinigung und zur Herstellung von Dispersionen eingesetzt. Sie bringen dadurch viele Vorteile mit sich. Gerade in der Lebensmitteltechnologie können Emulgatoren wahre Wunder vollbringen und Substanzen zusammenhalten, die sonst sehr schnell getrennt wären, z.B. in einer Sauce Hollandaise. Allerdings gelangen Tenside mit dem Abwasser auch in unsere Flüsse und Seen. Diese werden dadurch immer stärker belastet. Das kann zum Sterben zahlreicher Tier- und Pflanzenarten führen. Daher ist ein nachhaltiger und sparsamer Einsatz dieser Helfer nötig, um unsere Natur zu erhalten und zu schonen.
Alle Videos zum Thema
Videos zum Thema
Waschmittel (4 Videos)
Alle Arbeitsblätter zum Thema
Arbeitsblätter zum Thema
Waschmittel (3 Arbeitsblätter)
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- Fraktionierte Destillation Von Erdöl
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung
- Fermentation









 Tenside – Eigenschaften
Tenside – Eigenschaften
 Zusammensetzung von Waschmitteln
Zusammensetzung von Waschmitteln
 Waschwirkung
Waschwirkung












