Ethanol und weitere Alkohole
Reaktionsmechanismen der Alkohole
Beliebteste Videos und Lerntexte
Jetzt mit Spaß die Noten verbessern
und sofort Zugriff auf alle Inhalte erhalten!
30 Tage kostenlos testenInhaltsverzeichnis zum Thema
Die homologe Reihe der Alkanole
Die Alkanole gehören zu den Alkoholen, sie leiten sich von den Alkanen ab. Dies sind gesättigte Kohlenwasserstoffe.
Alle Alkanole besitzen eine oder mehrere Hydroxy-Gruppen $-OH$. Diese funktionelle Gruppe ist charakteristisch für alle Alkohole. Sie erhöht den polaren Charakter der Verbindungen gegenüber den Alkanen. Durch die hohe Differenz der Elektronegativität zwischen dem Sauerstoff- und dem Wasserstoffatom bilden sich ein negativer (Sauerstoff) und ein positiver (Wasserstoff) Ladungsschwerpunkt heraus. Dadurch wechselwirken die Moleküle miteinander und es entsteht eine Wasserstoffbrückenbindung. Dadurch liegen die Siedepunkte der Alkanole höher als die der Alkane mit vergleichbaren Molekülmassen.
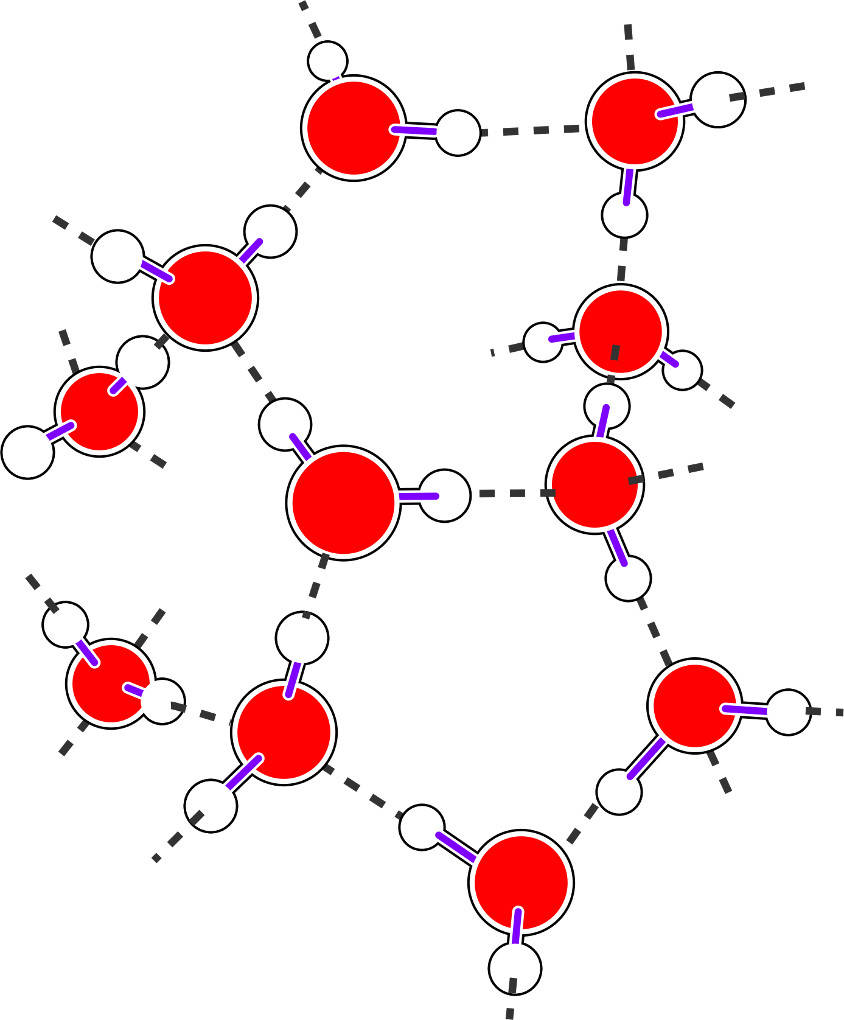
Die Benennung der Alkanole erfolgt nach IUPAC analog zu den Alkanen. Es wird die Anzahl der C-Atome durch das griechische Zahlwort beschrieben. Dann folgt die Silbe -an-, was das Vorliegen von ausschließlich Einfachbindungen symbolisiert, und am Ende die Silbe -ol. Diese zeigt das Vorhandensein der Hydroxy-Gruppe an.
Nach diesen Regeln heißt das Molekül $C_2H_5OH$ Eth-an-ol.
Alkanol ist allerdings nicht gleichbedeutend mit Alkohol. Es gibt auch Alkohole die Doppelbindungen (Alkenole) oder Dreifachbindungen (Alkinole) enthalten. Weiterhin gibt es bei Alkoholen die Unterscheidung nach der Stellung der Hydroxy-Gruppe. Steht diese am Ende der Kette, ist sie also endständig, handelt es sich um einen primären Alkohol.
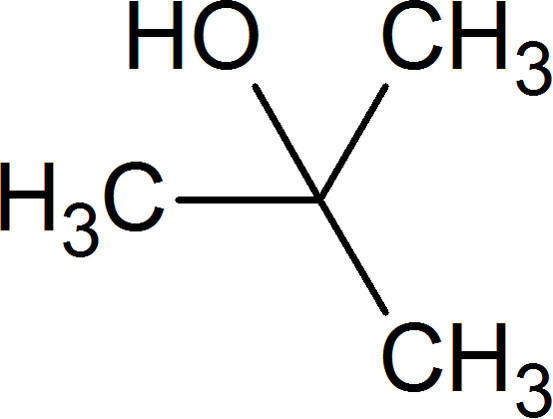
Befindet sich die Gruppe an einem C-Atom in der Kette ist es ein sekundärer Alkohol. Dies liegt daran, dass das C-Atom, welches die Hydroxy-Gruppe trägt, an 2 weitere C-Atome gebunden ist. Ist es an 3 C-Atome gebunden, spricht man von einem tertiären Alkohol. Hier siehst du den einfachsten tertiären Alkohol tert-Butanol.
Verwendung von Alkoholen
Bei dem Wort Alkohol denken die meisten natürlich sofort an den Trinkalkohol. Dabei handelt es sich um Ethanol $C_2H_5OH$. Dieser entsteht traditionell beim Bierbrauen, beim Gären von Wein und dem Schnapsbrennen. Wie du aber nun weißt, gibt es noch viele andere Alkohole, die sich in der Struktur von Ethanol unterscheiden.
Eine große Anwendung des Ethanols ist der Gebrauch als Genussmittel. Diese sozial akzeptierte Droge wirkt in kleinen Mengen anregend und setzt Hemmschwellen herab. In großen Dosen und regelmäßig eingenommen, verursacht Ethanol aber schwerwiegende Schäden am gesamten Körper. Ethanol ist ein Zellgift.

Das Gefühl des Betrunkenseins ist im Endeffekt nichts anderes als eine Vergiftungserscheinung. Schädigungen treten unter anderem im *Gehirn auf. Dies sind z.B. Gedächtnisverlust oder -lücken, verminderte Denkfähigkeiten und auch Orientierungsprobleme. Da Ethanol in der Leber abgebaut wird, ist dieses Organ bei übermäßigem Genuss besonders betroffen. Es kommt zu Leberverhärtungen, Leberzirrhose und schließlich zum Absterben von Teilen der Leber, was sich auf den gesamten Stoffwechsel auswirkt und auch zum Tod führen kann.
Alkohole bieten aber noch andere Verwendungsmöglichkeiten. So ist zum Beispiel Ethanol ein gutes Lösemittel für viele Stoffe. Es wird in Kosmetika wie Parfüms oder Cremes eingesetzt.
Auch in Medikamenten wie Hustensaft oder anderen Lösungen findet Alkohol Anwendung. Und natürlich ist die Reinigung und Desinfektion mit Alkohol ein großes Anwendungsgebiet.

Die chemische Industrie nutzt Alkohole außerdem als Ausgangsstoffe für vielfältige organische Syntheseverfahren.
Reaktionen von Alkohol
Alkohole zeigen eine große Reaktionsvielfalt und sind nicht so reaktionsträge wie die Alkane. Analog zu diesen zeigen sie aber auch eine Verbrennungsreaktion. Bei Anwesenheit von ausreichend Sauerstoff verbrennen Alkohole vollständig zu Kohlenstoffdioxid und Wasser. Hier siehst du die Verbrennung von Pentanol.
$C_5H_{11}OH + ~7,5~O_2 \longrightarrow~5~CO_2 + 6~H_2O$
Steht nicht genug Sauerstoff zur Verfügung, erfolgt eine unvollständige Verbrennung und es entstehen Kohlenmonoxid $CO$ und Ruß $C$.
Weitere Oxidationen sind möglich. Wird ein primärer Alkohol zu einer sogenannten milden Oxidation gebracht, entsteht ein Aldehyd. Läuft dieselbe Reaktion mit einem sekundären Alkohol ab, entsteht ein Keton. Wird das Aldehyd weiter oxidiert durch ein stärkeres Oxidationsmittel und/oder mehr Wärmeenergie, entsteht eine Carbonsäure.
Eine weitere wichtige Reaktion der Alkohole ist die Veresterung. Hier reagiert ein Alkohol mit einer Carbonsäure. Es wird Wasser abgespalten und Alkohol und Säure werden durch die Estergruppe miteinander verknüpft. Essigsäureethylester, ein gebräuchliches Lösemittel, siehst du hier:

Alle Videos und Lerntexte zum Thema
Videos und Lerntexte zum Thema
Ethanol und weitere Alkohole (7 Videos, 1 Lerntext)
Alle Arbeitsblätter zum Thema
Arbeitsblätter zum Thema
Ethanol und weitere Alkohole (7 Arbeitsblätter)
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- Fraktionierte Destillation Von Erdöl
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung
- Fermentation













 Alkohol – Konsummittel und Chemikalie
Alkohol – Konsummittel und Chemikalie
 Bierbrauen
Bierbrauen
 Ethanol als Lösungsmittel
Ethanol als Lösungsmittel
 Alkohole – Reaktionen (Vertiefungswissen)
Alkohole – Reaktionen (Vertiefungswissen)
 Alkohole – Reaktionen (Expertenwissen)
Alkohole – Reaktionen (Expertenwissen)
 Glycerin
Glycerin
 Primäre, sekundäre und tertiäre Alkohole
Primäre, sekundäre und tertiäre Alkohole












