Esterbildung und Hydrolyse
Erfahre, wie Alkohol und Säure reagieren, um Ester zu bilden. Diese Prozesse sind wichtig! Lerne, wie die Reaktion abläuft und warum Ester so bedeutend sind. Interessiert? Dies und vieles mehr findest du im folgenden Text!

in nur 12 Minuten? Du willst ganz einfach ein neues
Thema lernen in nur 12 Minuten?
-
 5 Minuten verstehen
5 Minuten verstehen
Unsere Videos erklären Ihrem Kind Themen anschaulich und verständlich.
92%der Schüler*innen hilft sofatutor beim selbstständigen Lernen. -
 5 Minuten üben
5 Minuten üben
Mit Übungen und Lernspielen festigt Ihr Kind das neue Wissen spielerisch.
93%der Schüler*innen haben ihre Noten in mindestens einem Fach verbessert. -
 2 Minuten Fragen stellen
2 Minuten Fragen stellen
Hat Ihr Kind Fragen, kann es diese im Chat oder in der Fragenbox stellen.
94%der Schüler*innen hilft sofatutor beim Verstehen von Unterrichtsinhalten.

Grundlagen zum Thema Esterbildung und Hydrolyse
Esterbildung und Esterhydrolyse – Chemie
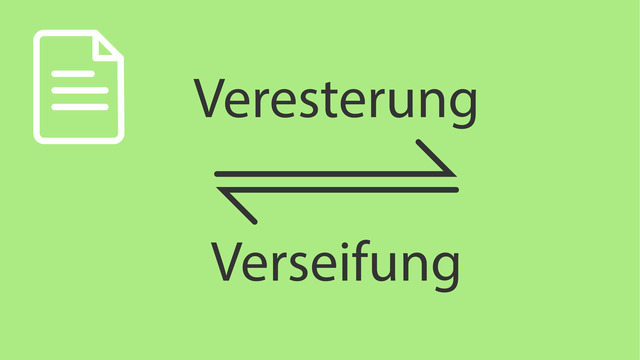
Alkohol und Säure reagieren zu einem Ester. Das wird dann als Esterbildung bezeichnet. Doch was versteht man unter Esterhydrolyse, wie entsteht ein Ester und wie nennt man die Reaktion der Esterbildung noch? Das erfährst du einfach erklärt in diesem Lerntext am Beispiel der Veresterung von Essigsäure.
Entstehung eines Esters
Allgemein findet eine Esterbildung, auch Veresterung genannt, durch die Reaktion einer Säure mit Alkohol unter Wasserabspaltung statt. An der Carboxylgruppe einer Carbonsäure kann ein nucleophiler Angriff eines Alkohols erfolgen, da am Kohlenstoffatom Elektronenmangel herrscht. Endprodukt dieser Reaktion ist dann ein Ester.
Hier siehst du die Reaktionsgleichung der Esterbildung am Beispiel von Essigsäure und Ethanol:
$\ce{\underset{Essigsäure}{CH3COOH} + \underset{Ethanol}{CH3CH2OH} <=>[\text{Veresterung } H+][Hydrolyse] \underset{Ethansäureethylester}{CH3COOCH2CH3} + \underset{Wasser}{H2O}}$
Esterbildung Mechanismus – Erklärung
Der Reaktionsmechanismus der Gleichgewichtsreaktion der Esterbildung verläuft in fünf Schritten:
| 1. Protonierung der Carboxylgruppe: | Durch den elektrophilen Angriff bildet sich ein Kation aus, das in einer mesomeren Grenzstruktur vorliegt. |
| 2. Nucleophiler Angriff des Alkoholmoleküls: | Bildung eines positiven Ions. Die Ladung befindet sich am Sauerstoffatom. |
| 3. Intramolekulare Protonenwanderung: | Protonenbewegung von einem Sauerstoff- zu dem anderen Sauerstoffatom. |
| 4. Eliminierung: | Wasserabspaltung unter Bildung eines Carbeniumions |
| 5. Deprotonierung: | Esterbildung unter Abspaltung des Katalysators |
Aus dem dargestellten Mechanismus lassen sich drei Schlussfolgerungen ableiten:
- Der Katalysator wird nicht verbraucht.
- Das Sauerstoffatom ($\ce{O}$) des Wassermoleküls $(\ce{H2O})$ stammt aus der Carboxylgruppe der Carbonsäure.
- Die Gesamtreaktion ist ein Additions-Eliminierungs-Mechanismus.
Esterhydrolyse
Was versteht man unter Esterspaltung? Bei der Veresterung handelt es sich um eine Gleichgewichtsreaktion (Estergleichgewicht), deren Umkehrreaktion definitionsgemäß als Hydrolyse, Esterhydrolyse oder Esterspaltung bezeichnet wird. Allgemein kann man die Reaktionsgleichung für die Esterbildung ohne Katalysator und Esterhydrolyse so formulieren:
$\ce{Säure + Alkohol <=>[Veresterung][Hydrolyse] Ester + Wasser}$
Synthese eines Esters
Das Gleichgewicht der Esterbildung kann mit dem Massenwirkungsgesetz beschrieben werden:
$K = \ce{ \frac{[Ester]\cdot[Wasser]}{[Säure]\cdot [Alkohol]}}$
Die Berechnung des Estergleichgewichts für die Bildung von Ethylacetat führt zu einer Gleichgewichtskonstante $K$ von vier.
Für eine ausreichende Synthese von Ethylacetat müssen bestimmte Bedingungen herrschen, da es sonst zu einer Rückreaktion kommt. Das bedeutet, wenn die Essigsäure mit dem Ethanol zu Ethylacetat reagiert, reagiert Letzteres durch Hydrolyse wieder zu Essigsäure und Ethanol und man erhält keine ausreichende Menge Ethylacetat.
Welche Möglichkeiten hat man, um die Ausbeute des Esters zu erhöhen?
- Ausgangskonzentration der Säure gegenüber dem Alkohol stark erhöhen, da es dann nach dem Massenwirkungsgesetz zu einer Erhöhung der Konzentration des Reaktionsprodukts kommt.
- Destillation des Esters
- Verwendung eines sauren Katalysators, der die Reaktionsgeschwindigkeit erhöht und damit eine schnelle Einstellung des chemischen Gleichgewichts verursacht. Man spricht dann auch von einer säurekatalysierten Esterbildung und Esterhydrolyse.
Dieses Video
Ester entstehen bei der Reaktion von Carbonsäuren mit Alkoholen unter Abspaltung von Wasser. Die Reaktion ist eine Gleichgewichtsreaktion. Die Hinreaktion heißt Esterbildung, die Rückreaktion ist die Hydrolyse. Bei der Synthese von Ethylacetat erzielt man hohe Ausbeuten an Ester durch hohe Konzentration an eingesetzter Säure, durch Entfernen des Esters und durch einen sauren Katalysator. Der Mechanismus der Veresterung läuft in den Stufen Protonierung, nucleophile Addition des Alkoholmoleküls, Migration eines Protons, Wasserabspaltung und Deprotonierung ab. Bei der Reaktion wird die Säure nicht verbraucht, die Reaktion verläuft nach einem Additions-Eliminierungs-Mechanismus und das Sauerstoffatom im Wassermolekül stammt aus der Carboxylgruppe.
Im Anschluss an das Video und diesen Text findest du Übungsaufgaben und Arbeitsblätter zu dem Thema Esterbildung und Hydrolyse, um dein erlerntes Wissen zu überprüfen. Viel Spaß!
Transkript Esterbildung und Hydrolyse
Guten Tag und herzlich willkommen. Dieses Video heißt "Esterbildung und Hydrolyse". Um dieses Video gut verstehen zu können, solltet ihr mit einigen wichtigen Substanzklassen vertraut sein. Ihr solltet wissen, was eine Carbonsäure ist. Ihr solltet darüber Bescheid wissen, was ein Alkohol ist, ein Ester und ein Säurechlorid. Außerdem solltet ihr mit den Begriffen "Chemisches Gleichgewicht", "Nucleophil" und "Elektrophil" vertraut sein. Es wäre schön, wenn ihr die Videos zur Kinetik bereits gesehen habt. Dann wisst ihr auch, was die Begriffe Katalyse, Reaktionsgeschwindigkeit und Reaktionsmechanismus bedeuten. Das Video ist folgendermaßen gegliedert: 1. Entstehung eines Esters 2. Das Ester Gleichgewicht 3. Günstige Bedingungen 4. Der Mechanismus 5. Schlussfolgerungen 6. Zusammenfassung
- Entstehung eines Esters. Ein Ester kann sich aus einer Carbonsäure bilden. Am Kohlenstoffatom der Carboxylgruppe herrscht Elektronenmangel. Daher kann dort ein nucleophiler Angriff erfolgen. Es erfolgt der Angriff des nucleophilen Alkoholmoleküls. Über einige Reaktionsschritte, die Gleichgewichtsreaktionen sind, bildet sich der Ester und Wasser wird frei. Aus der Carbonsäure und dem Alkohol entstehen der Ester und Wasser. Man kann auch vereinfacht formulieren: eine Säure+Alkohol->Ester+Wasser in einer Gleichgewichtsreaktion.
- Das Estergleichgewicht. Wir haben im Abschnitt 1 formuliert: Säure+Alkohol stehen im chemischen Gleichgewicht zu Ester und Wasser. Bei Einstellung des chemischen Gleichgewichts kann das Massenwirkungsgesetz zur Anwendung kommen. (Konzentration des Esters×Konzentration des Wassers)/(Konzentration der Säure)×(Konzentration des Alkohols)=Gleichgewichtskonstante. Bei der Synthese von Ethylacetat ergibt sich für das Massenwirkungsgesetz eine Gleichgewichtskonstante von 4.
- Günstige Bedingungen. Bei der Synthese von Ethylacetat müssen bestimmte Ausgangsverbindungen vorliegen. Es sind hier Essigsäure und Ethanol. Es entstehen folgerichtig Ethylacetat und Wasser. Eine Möglichkeit die Ausbeute des Esters zu erhöhen besteht darin, die Ausgangskonzentration der Säure gegenüber dem Alkohol stark zu erhöhen. Nach dem Massenwirkungsgesetz kommt es zu einem Anstieg der Konzentration des Reaktionsproduktes des Esters. Ein weiteres Verfahren besteht darin die unterschiedlichen Siedetemperaturen der Edukte und Produkte auszunutzen. Die Siedetemperatur des gebildeten Esters ist geringer als die Siedetemperatur der eingesetzten Essigsäure. Daher ist es sinnvoll den Ester abzudestillieren. Der Alkohol wird dabei nicht abdestilliert, da er bei der Reaktion in geringer Konzentration vorliegt und sofort umgesetzt wird. Das gebildete Wasser wird von der großen Menge an Carbonsäure festgehalten. Die 3. Möglichkeit große Mengen an Ester zu gewinnen, besteht in der Verwendung eines sauren Katalysators. Es kommt dabei zu einer schnelleren Einstellung des chemischen Gleichgewichts. Das chemische Gleichgewicht an sich wird von dem Einsatz des Katalysators nicht berührt. Lediglich die Reaktionsgeschwindigkeit wird erhöht. Wenn Säure und Alkohol zu den entsprechenden Reaktionsprodukten reagieren, so sprechen wir von Esterbildung. Die Umkehrreaktion, die Reaktion des Esters mit Wasser zu Säure und Alkohol, wird als Hydrolyse bezeichnet. Betrachten wir nun den Mechanismus dieser Gleichgewichtsreaktion. Der 1.Schritt der Reaktion ist die Protonierung. Das Proton greift das Carbonylsauerstoffatom der Carboxylgruppe der Säure an. Durch den elektrophilen Angriff bildet sich ein positiv geladenes Ion. Als 2. mesomere Grenzstruktur kann man für dieses Ion auch ein Carbeniumion formulieren. Der zweite Reaktionsschritt ist der nucleophile Angriff des Alkoholmoleküls. Durch die vorangegangene Protonierung wird er stark erleichtert. Im Ergebnis entsteht ein positiv geladenes Ion, das die positive Ladung am Sauersstoffatom, das ehemals zum Alkoholmolekül gehört hat, trägt. Im 3. Schritt findet eine Protonenmigration, das heißt eine Protonenbewegung von einem Sauerstoffatom zum anderen Sauerstoffatom statt. Darauf erfolgt die Wasserabspaltung unter Bildung eines Carbeniumions. Der letzte Schritt und die Bildung des Esters erfolgt durch Deprotonierung. Ich möchte noch die anderen Reaktionspartner ins Reaktionsschema eintragen. Den Ester haben wir schon, dann das Wasser, die Säure und den Alkohol. Haltet das Video einmal an und schaut euch diesen Mechanismus in Ruhe einige Minuten an.
- Schlussfolgerung. Aus dem dargestellten Mechanismus lassen sich einige wichtige Schlüsse ziehen. 1. Der Katalysator wird nicht verbraucht. 2. Das Sauerstoffatom des Wassermoleküls stammt aus der Carboxylgruppe der Carbonsäure. 3. Die Gesamtreaktion entspricht einem Additions-Eliminierungs-Mechanismus. Wir wollen nun die Ergebnisse in Punkt 6 zusammenfassen. Die Reaktion einer Carbonsäure mit einem Alkohol wird als Esterbildung bezeichnet. Die Rückreaktion, die Reaktion des Esters mit Wasser, nennt man Hydrolyse. Man formuliert Säure+Alkohol stehen im chemischen Gleichgewicht zu Ester und Wasser. Nach dem Massenwirkungsgesetz ergibt sich (Esterkonzentration×Wasserkonzentration)/(Säurekonzentration×Alkoholkonzentration) ist die Gleichgewichtskonstante. Um hohe Ausbeuten an Ester zu erzielen, ist es sinnvoll die Säurekonzentration gegenüber der Alkoholkonzentration hochzuhalten. Außerdem ist es sinnvoll den Ester abzudestillieren und als 3. einen Katalysator für die schnelle Einstellung des chemischen Gleichgewichtes zu verwenden. Der Mechanismus der Reaktion erfolgt in 5 Stufen. Die 1. Stufe ist die Protonierung des Carbonsäuremoleküls. Daran schließt sich der nucleophile Angriff des Alkoholmoleküls an das gebildete Ion an. Der 3. Rekationsschritt ist die Migration eines Protons von einem Sauerstoffmolekül zum anderen. Der 4. Reaktionsschritt ist die Wasserabspaltung unter Bildung eines Carbeniumions und schließlich für die Deprotonierung zur Entstehung des Esters. 3 wichtige Folgerungen lassen sich aus dem Mechanismus der Reaktion ableiten. 1. Es kommt zu keinem Verbrauch der Wasserstoffionen. Der Katalysator verbraucht sich nicht. 2. Das Sauerstoffatom des Wassers entstammt der Carboxylgruppe der Carbonsäure. Und 3. Die Reaktion verläuft nach einem Additions-Eliminierungs-Mechanismus ab. Das wars auch schon wieder. Ich wünsche euch alles Gute und viel Erfolg. Auf Wiedersehen.
Esterbildung und Hydrolyse Übung
-
Bestimme die folgenden Verbindungsklassen.
TippsDas Sauerstoffatom in Alkoholen ist z.B. nucleophil.
LösungNucleophil sind Atome, die freie Elektronenpaare besitzen, wie z.B. das Sauerstoffatom in Alkoholen und das Stickstoffatom in Aminen, aber auch das Clorid-Ion ist nucleophil. Elektrophil sind Atome, die einen Elektronenmangel haben. Diese werden bei einer chemischen Reaktion von einem Nucleophil angegriffen. Elektrophile Atome sind z.B. das Kohlenstoffatom an einer OH-Gruppe sowie das Kohlenstoffatom in einer Aldehyd- und Carboxylgruppe. Um nun komplexere Reaktionsmechanismen, wie die Esterbildung, verstehen zu können, ist es wichtig, die beteiligten Verbindungsklassen und das Reaktionsverhalten zu kennen.
-
Erkläre die Entstehung eines Esters.
TippsÜberlege, welcher Stoff die Carboxylgruppe enthält.
Dem C-Atom der Carboxylgruppe fehlen Elektronen.
Welcher Angriff muss erfolgen, damit das C-Atom keinen Elektronenmangel mehr hat?
LösungEin Carbonsäureester entsteht bei der Reaktion zwischen einer Carbonsäure und einem Alkohol. Diese Reaktion erfolgt über mehrere Schritte. Das C-Atom in der Carboxylgruppe ist auf Grund der positiven Partialladung elektrophil, also es mangelt an Elektronen. Das Alkoholmolekül ist nucleophil, da am Sauerstoffmolekül freie Elektronenpaare vorhanden sind. Deshalb können dem C-Atom Elektronen „abgeben“ werden. Es erfolgt der sogenannte nucleophile, also kernliebende Angriff des Sauerstoffatoms am Kohlenstoffatom. Bei dieser Reaktion bildet sich nicht nur der Ester, sondern auch ein Molekül Wasser.
-
Entscheide, in welcher Reihenfolge die Esterbildung abläuft.
TippsZuerst lagern sich Protonen an eine chemische Bindung.
Zum Schluss spalten sich die Protonen wieder ab.
LösungZuerst erfolgt die Protonierung, d.h. dass das Proton das doppelgebundene Sauerstoffatom der Carboxylgruppe angreift. Durch den elektrophilen Angriff bildet sich ein positiv geladenes Ion.
Als nächstes erfolgt der nucleophile Angriff durch das Alkoholmolekül. Dabei entsteht ein positiv geladenes Ion, das die positive Ladung am Sauerstoffatom, welches aus dem Alkohol stammt, trägt. Im Anschluss folgt die Protonenmigration. Dabei bewegt sich das Proton von einem Sauerstoffatom zu einem anderen. Danach erfolgt die Wasserabspaltung unter Bildung eines Cabenium-Ions. Zum Schluss kommt die Deprotonierung, bei der sich das Proton wieder abspaltet, wodurch sich eine Doppelbindung vom Sauerstoffatom ausbilden kann. Es entsteht der Ester.
-
Bezeichne die folgenden Ester.
TippsEin Ester beginnt immer mit Säurenamen.
Danach folgt die Bezeichnung für den Alkohol.
LösungDu kannst nur aus der Formel des Esters den Namen für ihn ablesen. Man beginnt zunächst mit dem Namen der Carbonsäure. Zum Beispiel ist es die Propansäure, wenn die Säure aus drei C-Atomen besteht. Danach folgt der Name des Alkohols. Es ist zum Beispiel das Kürzel Methyl für Methanol, wenn ein C-Atom im Alkohol vorhanden ist. Am Ende wird dann nur noch das Wort Ester angehangen. Beachte, dass viele Ester auch einen Trivialnamen haben.
Der Butansäureethylester wird auch als Buttersäureethylester bezeichnet.
-
Gib die Schlussfolgerungen aus der Bildung eines Esters wieder.
TippsBei einer Addition wird ein kleineres Molekül an eine Doppelbindung eines ungesättigten Moleküls angelagert.
Überlege, ob ein Nebenprodukt entsteht.
LösungEine Additionsreaktion ist eine chemische Reaktion, bei der ein kleineres Molekül an eine Doppel- oder Dreifachbindung eines ungesättigten Moleküls angelagert wird. Die Eliminierungsreaktion ist eine chemische Reaktion, bei der Atome oder Atomgruppe aus den Ausgangsstoffen abgespaltet werden, in unserem Beispiel das Wasser. Der Katalysator wird nicht verbraucht, da er nicht aktiv an der Reaktion teilnimmt, sondern nur die Reaktion beschleunigt, indem er die Aktivierungsenergie herabsetzt.
-
Erkläre, durch welche Vorgehensweise die Ausbeute an Butansäuremethylester erhöht werden kann.
TippsÜberlege, wie man man am besten die unterschiedlichen Siedetemperaturen nutzen kann.
Überlege, durch was die Reaktionsgeschwindigkeit beeinflusst wird.
LösungEine höhere Ausbeute erreicht man zu einem durch die Konzentrationserhöhung. Durch die Erhöhung der Konzentration der Säure wird die Reaktion gefördert, bei der sie verbraucht wird, somit entsteht mehr Ester. Nach demselben Prinzip läuft die Konzentrationserniedrung des Esters durch Destillation ab. Erniedrigt man die Konzentration des Esters, dann wird die Reaktion gefördert, bei der er gebildet wird – und mehr Ester entsteht. Durch einen sauren Katalysator erreicht man ein schnelleres Einstellen des Gleichgewichts, da die Aktivierungsenergie der Reaktion herabgesetzt wird. Bedenke, dass ein Katalysator niemals verbraucht wird.
9.178
sofaheld-Level
6.600
vorgefertigte
Vokabeln
8.108
Lernvideos
37.100
Übungen
33.418
Arbeitsblätter
24h
Hilfe von Lehrkräften

Inhalte für alle Fächer und Klassenstufen.
Von Expert*innen erstellt und angepasst an die Lehrpläne der Bundesländer.
Testphase jederzeit online beenden
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- Fraktionierte Destillation Von Erdöl
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung
- Fermentation


 5 Minuten verstehen
5 Minuten verstehen
 5 Minuten üben
5 Minuten üben
 2 Minuten Fragen stellen
2 Minuten Fragen stellen

 Bereit für eine echte Prüfung?
Bereit für eine echte Prüfung?


















@Martha, vielen Dank für den Hinweis, du hast völlig recht! Ich habe die Gleichung ausgebessert, jetzt passt es.
Bei der Beschreibung unter Esterhydrolyse stimmt die Wortgleichung glaub ich nicht. Auf der rechten Seite muss Ester+Wasser stehen oder nicht?
Bei Aufgabe 4 stimmt bei der 4. Reaktionsgleichung die Bennenung nicht: Auf dem Bild ist Pentansäurepropylester abgebildet, jedoch gibt es als Auswahlmöglichkeit nur Hexansäurepropylester, was hier dann auch als richtige Antwort gewertet wird.
Veresterung "Esterbildung" ist eine chemische Reaktion, bei der die beiden Komponenten (Alkohol und Säure) fast immer rein eingesetzt werden. An der Konzentration ist da nicht viel zu drehen. Manchmal wird eine Komponente im Überschuss eingesetzt, das ändert aber prinzipiell nichts an dem Tatbestand.
Ein Alkohol kann kein Proton für die Katalyse liefern, denn er ist noch schwächer sauer als Wasser. Für den Start (die Katalyse) der Reaktion muss das Proton von einer starken Broensted-Säure (Schwefelsäure, Trifluormethansulfonsäure, einem sauren Ionenaustauscher oder dem supersuren Nafion-50) stammen. Dass dann das Alkoholmolekül während der Reaktion ein Proton abspaltet ist dann ein Ergebnis des ursprünglichen elektrophilen Angriffs des "Katalyse - Protons".
Alles Gute
Und noch eine Frage: Bei Punkt 4 "Der Mechanismus" greift zu Beginn das Proton als Elektrophil das nucleophile Zentrum der Carbonylgruppe an. Meine Frage ist, woher kommt dieses Proton? Vom Alkohol oder ist das vom Katalysator?