Salze – Eigenschaften und Bildung
Salze sind ionische Verbindungen und entstehen neben Wasser bei Neutralisationsreaktionen zwischen Säuren und Basen.
Beliebteste Videos und Lerntexte
Jetzt mit Spaß die Noten verbessern
und sofort Zugriff auf alle Inhalte erhalten!
30 Tage kostenlos testenInhaltsverzeichnis zum Thema
Was sind Salze?
Unter dem Begriff Salz kennst du wahrscheinlich das Kochsalz. Da dieses Salz das am meisten von uns Menschen verwendete ist, hat sich dieser Name für das Natriumchlorid eingebürgert.

Es gibt aber noch sehr viel mehr Salze. Was sie alle gemeinsam haben ist, dass sie aus Kationen, das sind positiv geladene Teilchen, und Anionen, das sind die negativ geladenen Teilchen, aufgebaut sind. Die Kationen werden häufig von Metallen gebildet und die Anionen von Nichtmetallen. Die Salze werden zusammengehalten durch die starken Anziehungskräfte zwischen diesen Ionen. Diese Anziehung wird als Ionenbindung bezeichnet.
Eigenschaften
Salze besitzen charakteristische Eigenschaften. Sie sind aufgrund der starken Bindung hochschmelzend. Bei Raumtemperatur liegen sie daher im festen Aggregatzustand vor. Salze sind nicht brennbar und generell chemisch eher träge, da sie bereits einen relativ stabilen Zustand erreicht haben. In dem polaren Lösemittel Wasser sind viele Salze gut löslich. Allerdings gibt es auch schwerlösliche Salze, die man zum Beispiel für Nachweisreaktionen nutzt. Beim Auflösen eines Salzes kommt es zur Dissoziation, diese beschreibt das Auflösen des Ionengitters. In gelöstem Zustand sind Salze in der Lage, den elektrischen Strom zu leiten. Auch in der Schmelze ist dies möglich. Das liegt daran, dass in beiden Zuständen die Ionen freibeweglich sind und Ladungen transportieren können.
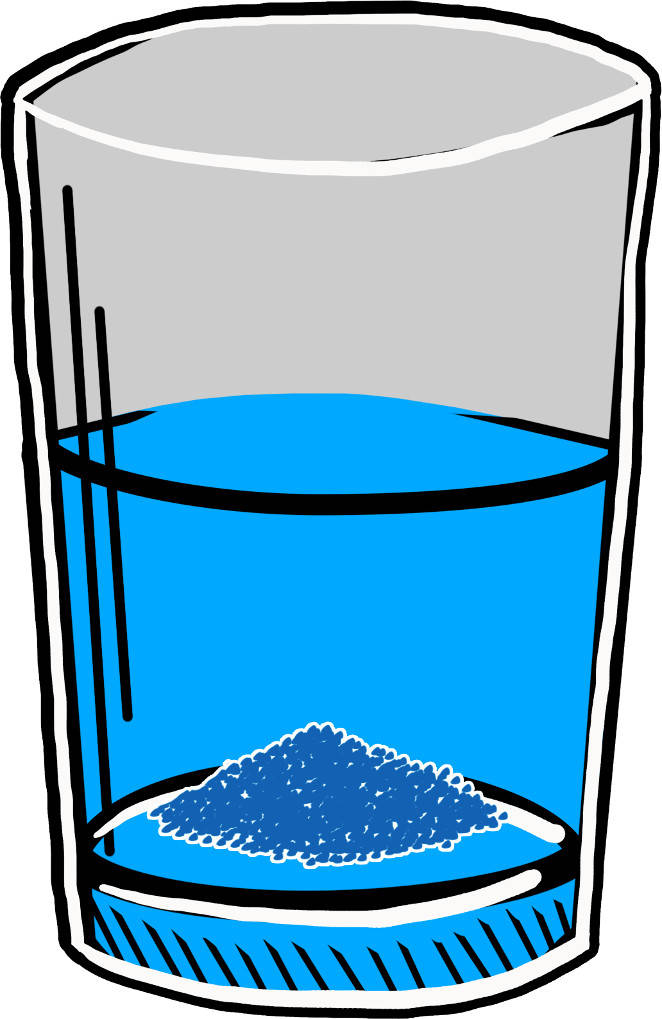
Salze sind spröde. Man spricht hier auch vom spröden Bruch. Wenn man sich den Aufbau einmal anschaut, lässt sich dieses Phänomen erklären. Kationen und Anionen liegen abwechselnd im Salz vor. Bricht der Festkörper nun an einer Stelle rutschen die Schichten aneinander vorbei. So können sich gleich geladene Ionen gegenüberliegen. Es kommt zu einer Abstoßung aufgrund der gleichartigen Ladung und somit zum spröden Bruch.
Bildung von Salzen
In der Natur begegnen uns sehr viele Salze. Sie werden auch Mineralien und Erze genannt. Bestandteile dieser Erze sind unedle Metalle. Sie findest du nur in Verbindungen vor, da sie in elementarer Form zu reaktiv sind.
Das sagt dir schon viel über die Entstehung von Salzen. Es reagieren also ein Metall und ein Nichtmetall zu einem Salz. Da Salze einen sehr stabilen und damit energiearmen Zustand darstellen, verläuft die Reaktion meist heftig und unter Wärme- und Lichtabgabe. Solch eine Reaktion wird als exotherm bezeichnet. So kann man also elementares Natrium mit Chlorgas zur Reaktion bringen und erhält das gewöhnliche Kochsalz.
$2 Na + Cl_2 \longrightarrow 2 NaCl$
Ionenbindung
Es gibt verschiedene Arten von Bindungen. Zum einen gibt es kovalente und ionische Bindungen. Sie sind meist spezifisch für eine größere Menge an Verbindungen, die einige Eigenschaften miteinander teilen. Bindungen sind hauptverantwortlich für die innerstofflichen Kräfte und haben einen großen Einfluss auf die Eigenschaften eines Stoffes.
Wie ist der Zusammenhang zwischen Salzen und Ionengittern? Alle Salze weisen eine Ionenbindung auf. Diese Bindung macht sie also erst zu Salzen. Es ist die stärkste Art der Bindung. Darum sind alle Salze Festkörper bei Raumtemperatur und weisen einen relativ hohen Schmelzpunkt auf. Die große Stärke der Bindung beruht auf elektrostatischen Wechselwirkungen. Die positiven Metall-Ionen und die negativen Nichtmetall-Ionen ziehen sich gegenseitig an, da sie entgegengesetzt geladen sind. Diese Anziehung ist so stark, dass sie sich zu regelmäßigen, kompakten Gittern zusammensetzen.
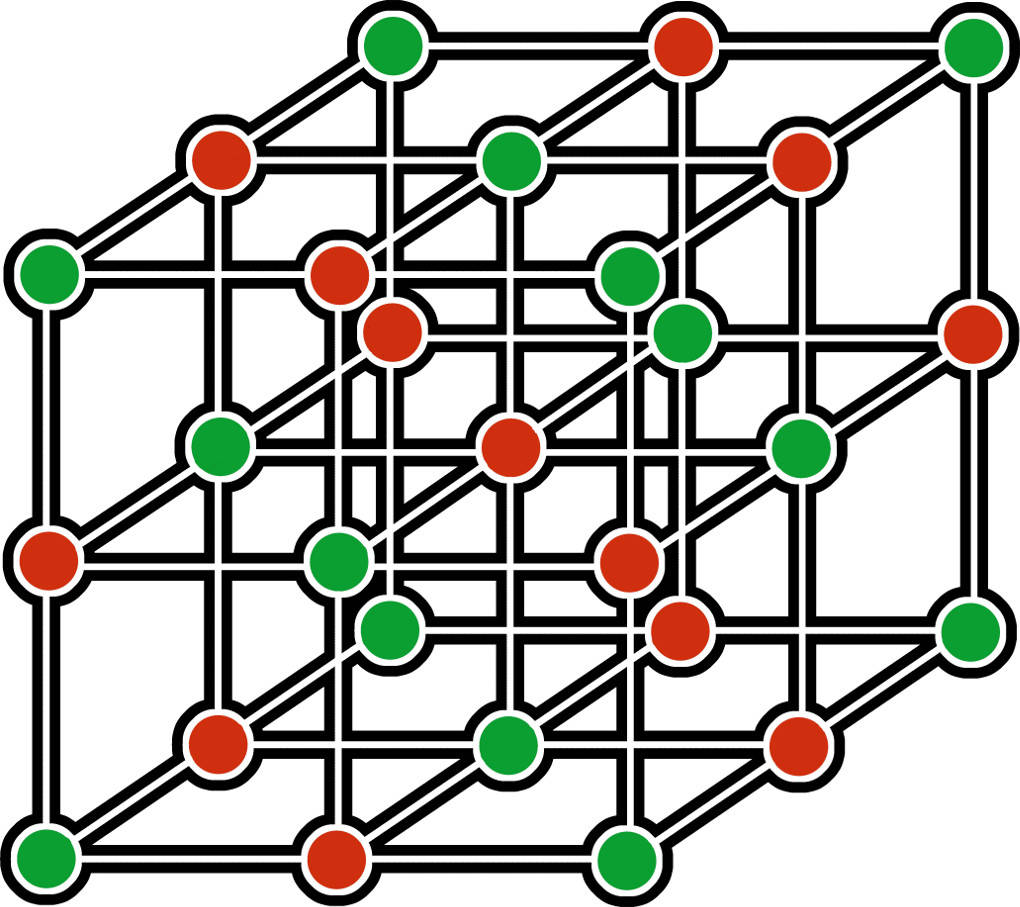
Man spricht dabei von der dichtesten Packung. Nach außen hin ist das Salz aber elektrisch neutral. Das bedeutet, es gibt innerhalb des Gitters genauso viele positive Ladungen wie negative.
Salze sind also Festkörper mit ganz spezifischen Eigenschaften. Sie sind aufgebaut aus positiven Kationen und negativen Anionen. Die vorherrschende Bindungsart ist die Ionenbindung, wodurch Salze Gitterstrukturen bilden.
Alle Videos und Lerntexte zum Thema
Videos und Lerntexte zum Thema
Salze – Eigenschaften und Bildung (9 Videos, 1 Lerntext)
Alle Arbeitsblätter zum Thema
Arbeitsblätter zum Thema
Salze – Eigenschaften und Bildung (8 Arbeitsblätter)
-
 Salze – Einführung
PDF anzeigen
Salze – Einführung
PDF anzeigen -
 Bildung von Ionen und Ionenbindung
PDF anzeigen
Bildung von Ionen und Ionenbindung
PDF anzeigen -
 Kationen, Anionen und die Neigung zur Ionenbildung
PDF anzeigen
Kationen, Anionen und die Neigung zur Ionenbildung
PDF anzeigen -
 Salze – Ionengitter und Kristalle
PDF anzeigen
Salze – Ionengitter und Kristalle
PDF anzeigen -
 Salzdarstellungsverfahren
PDF anzeigen
Salzdarstellungsverfahren
PDF anzeigen -
 Dissoziation
PDF anzeigen
Dissoziation
PDF anzeigen -
 Hydratation von Ionen
PDF anzeigen
Hydratation von Ionen
PDF anzeigen -
 Kristallzüchten
PDF anzeigen
Kristallzüchten
PDF anzeigen
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- Fraktionierte Destillation Von Erdöl
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung
- Fermentation
























