D-Ribopyranose und D-Ribofuranose

in nur 12 Minuten? Du willst ganz einfach ein neues
Thema lernen in nur 12 Minuten?
-
 5 Minuten verstehen
5 Minuten verstehen
Unsere Videos erklären Ihrem Kind Themen anschaulich und verständlich.
92%der Schüler*innen hilft sofatutor beim selbstständigen Lernen. -
 5 Minuten üben
5 Minuten üben
Mit Übungen und Lernspielen festigt Ihr Kind das neue Wissen spielerisch.
93%der Schüler*innen haben ihre Noten in mindestens einem Fach verbessert. -
 2 Minuten Fragen stellen
2 Minuten Fragen stellen
Hat Ihr Kind Fragen, kann es diese im Chat oder in der Fragenbox stellen.
94%der Schüler*innen hilft sofatutor beim Verstehen von Unterrichtsinhalten.
Grundlagen zum Thema D-Ribopyranose und D-Ribofuranose
In diesem Video geht es allgemein um die Ringbildung bei Monosacchariden und speziell um die D-Ribopyranose und die D-Ribofuranose. Dazu wird zuerst ein kurzer Überblick über die Pyranosen und die Furanosen gegeben und im Anschluss am Beispiel der D-Ribose die Bildung von vier Ringstrukturen gezeigt.
Transkript D-Ribopyranose und D-Ribofuranose
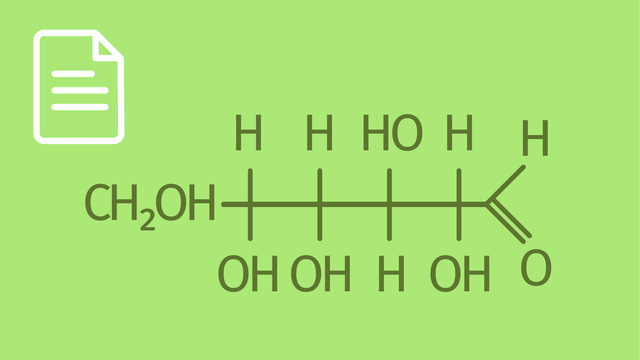
Guten Tag und herzlich willkommen! Dieser Film heißt D-Ribopyranose und D-Ribofuranose. Für das Verständnis dieses Filmes solltet ihr über einige Vorkenntnisse verfügen. Ihr habt schon recht gute Kenntnisse über Monosaccharide. Ihr wisst, dass ihre Moleküle als Ketten oder als Ringe auftreten. Ihr seid mit der Fischer-Projektion und den Haworth-Formeln gut vertraut. Ihr kennt euch mit der D/L-Nomenklatur gut aus. Ihr wisst, was Anomere sind und habt bereits das Video über Pyranosen und Furanosen gesehen. Ziel des Filmes ist es, ein tieferes Verständnis über die Struktur der Monosaccharide zu vermitteln. Der Film ist klein. Ich werde daher auf eine Inhaltsangabe und eine Zusammenfassung verzichten. 1. Pyran und Furan. Beginnen wir mit der Skelettformel eines Moleküles. Hierbei handelt es sich um Pyran. Wenn wir die Doppelbindungen durchhydrieren und das Sauerstoffatom nach oben rechts legen, so erhalten wir eine neue chemische Verbindung. Es handelt sich hier um Tetrahydro-pyran. Tetrahydropyran bildet das Grundgerüst vieler Monosaccharide, der Pyranosen. Ein anderer Grundkörper der Monosaccharide wird vom Furan abgeleitet. Das Furanmolekül bildet einen Fünfring, den wir bereits aus der Aromatenchemie kennen. Eine vollständige Hydrierung der Doppelbindungen ergibt eine gesättigte chemische Verbindung. Es handelt sich um Tetrahydro-furan. Tetrahydro-furan bildet den Grundkörper mancher Monosaccharide, der Furanosen. 2. Von der Kette zum Ring. Wir haben bereits gelernt, dass Monosaccharide sowohl als Kette als auch als Ring auftreten. Wobei dem Ring der Vorzug zu geben ist. Für unseren Film gehen wir von folgendem Fischerskelett aus. Es handelt sich hier um einen C5-Körper, also um eine Pentose. Nach der Fischer-Nomenklatur steht das Kohlenstoffatom mit der höchsten Oxidationsform oben. Das heißt, die Pentose verfügt über eine Aldehydgruppe. Demzufolge handelt es sich hier um eine Aldose. Die Hydroxygruppen an den drei chiralen Zentren sollen rechts liegen. Unten befindet sich die Hydroxymetylgruppe. Mit Sternchen markieren wir die chiralen Zentren. Die Hydroxygruppe am unteren chiralen Zentrum befindet sich rechts. Nach der D/L-Nomenklatur gehört dieses Molekül zur D-Reihe. Bei dem dargestellten Monosaccharid handelt es sich um D-Ribose. Das Molekül der D-Ribose wurde als Kette in der Fischerprojektion dargestellt. Ich möchte nun den Ringschluss veranschaulichen. Dazu werden jene Kohlenstoffatome mit Nummern versehen, die am Ringschluss beteiligt sind. Eins oben und vier am unteren chiralen Kohlenstoffatom. Beim Ringschluss wandert das Wasserstoffatom der Hydroxygruppe, des Kohlenstoffatoms 4 zum Sauerstoffatom der Aldehydgruppe oben. Der eigentliche Ringschluss findet zwischen dem Sauerstoffatom 4 und dem Kohlenstoffatom 1 statt. Man erhält einen Fünfring, eine Furanose. Die Lage von Wasserstoffatom und Hydroxygruppe am anomeren Kohlenstoffatom 1 kann verschieden sein. Wir nehmen an, dass die Hydroxygruppe nach unten zeigt. Damit haben wir es mit dem Alpha-Anomer zu tun. Die anderen Kohlenstoffatome des Rings werden auch noch nummeriert. Am vierten Kohlenstoffatom zeigt die Hydroxygruppe nach oben. Sie enthält das fünfte Kohlenstoffatom der offenkettigen Verbindung der D-Ribose. Die Lagen der beiden anderen Hydroxygruppen kann man mit der Floh-Regel bestimmen. Wir erinnern uns: Fischer - links, oben - Haworth. Wenn beide Hydroxygruppen in der Fischerprojektion in den Positionen 2 und 3 nach rechts gerichtet sind, müssen sie in der Haworth-Formel nach unten weisen. In Position 4 ist noch ein Strich nach unten gerichtet. Dort befindet sich ein Wasserstoffatom. Aus Gründen der Vereinfachung wird er einfach gelöscht. Das entstandene Molekül ist die alpha-D-Ribofuranose. Gewöhnlich wird in der Fachliteratur das Wasserstoffatom am anomeren Kohlenstoffatom 1 nicht eingezeichnet. 3. Vier Ringisomere aus einer Kette. Um die Kettenbildung zu veranschaulichen, möchte ich oben in der Mitte das D-Ribose-Molekül kurz vor dem Entstehen der Kette aufzeichnen. Es ist schon ersichtlich, dass sich ein Sechsring bilden soll. Die Kohlenstoffatome werden mit den Ziffern 1 bis 5 belegt. Die Hydroxygruppen in den Positionen 4, 3 und 2 zeigen nach unten. Es es entsteht ein Sechsring, eine Pyranose. Die Hydroxygruppe am anomeren Kohlenstoffatom 1 soll hier nach unten weisen. Die Ausrichtung der Hydroxygruppen in den Positionen 4, 3 und 2 kann mithilfe der Floh-Regel bestimmt werden. Da die Hydroxygruppe in 1 nach unten gerichtet ist, handelt es sich hier um ein alpha-Anomer. Ist die Hydroxygruppe am anomeren Kohlenstoffatom eins nach oben gerichtet, so handelt es sich um das beta-Anomer. Alle anderen Strukturelemente stimmen von alpha- und beta-Anomer vollständig überein. Nun möchte ich das offenkettige Molekül der D-Ribose darstellen, kurz bevor es zum Ringschluss zu einem Fünfring ansetzt. Wichtig ist hier, dass die Hydroxy-Metylgruppe an Position 4 sitzt und nach oben gerichtet ist. Ihr Bestandteil ist das Kohlenstoffatom 5. Die Fünfringbildung haben wir bereits in Teil 2 besprochen. Am anomeren Kohlenstoffatom 1 ist die Hydroxygruppe nach unten gerichtet. Es handelt sich somit um das alpha-Anomer. Die Hydroxygruppe in Position 4 mit dem Kohlenstoffatom 5 ist nach oben gerichtet. Die Hydroxygruppen in den Positionen 2 und 3 zeigen nach unten. Das kann mithilfe der Floh-Regel aus der Kette ableiten. Ist die Hydroxygruppe am anomeren Kohlenstoffatom 1 nach oben gerichtet, so hat sich das beta-Anomer gebildet. In allen anderen Strukturelementen ist das beta-Anomer mit dem alpha-Anomer identisch. Ausgegangen sind wir von einem Molekül der D-Reihe, deshalb müssen auch alle Ringverbindungen zur D-Reihe gehören. Die Verbindung oben links ist alpha-D-Ribopyranose. Bei der Verbindung oben rechts handelt es sich um beta-D-Ribopyranose. Unten links haben wir es mit alpha-D-Ribofuranose zu tun. Und unten rechts schließlich haben wir ein Molekül der beta-D-Ribofuranose vor uns. Somit können aus dem offenkettigen Molekül der D-Ribose 4 Ringisomere entstehen. Ich danke für die Aufmerksamkeit. Alles Gute!
D-Ribopyranose und D-Ribofuranose Übung
-
Beschreibe den Ringschluss von der D-Ribose zur D-Ribofuranose.
TippsDer Ring eines Zuckermoleküls besteht stets aus einem Sauerstoffatom und vier oder fünf Kohlenstoffatomen!
LösungDer Ringschluss bei Zuckern ist eine gut bekannte Reaktion, die zwischen Aldehyden und Alkohlen häufig stattfindet. Die Produkte der Reaktion werden als Halbacetale bezeichnet, der Ringschluss bei Monosacchariden ist ein typisches Beispiel für die Halbacatalbildung.
Halbacetale zeichnen sich durch eine Ether-Bindung zwischen zwei Kohlenwasserstoff-Resten aus, wobei an eines der dem Sauerstoff benachbarten Kohlenstoffatome eine Hydroxy-Gruppe gebunden ist.
In Zuckermolekülen sind sowohl Hydroxy-Gruppen als auch eine Aldehydgruppe vorhanden. Daher kann es intramolekular zur Bildung eines Halbacetals kommen. Die ringförmigen Halbacetale sind stabil, wenn der Ring nicht unter Spannung steht. Dies ist ab einer Ringgröße von fünf Ringatomen der Fall. Daher kommen Monosaccharide nur in Ringen mit fünf oder sechs Atomen vor, obwohl auch Ringe mit weniger Ringatomen denkbar wären. -
Gib die Namen der D-Ribosemoleküle wieder.
TippsMonosaccharide, die sich vom Furan ableiten lassen, werden als Furanosen bezeichnet, solche, die sich vom Pyran ableiten lassen als Pyranosen!
Furanosen bilden einen Ring aus fünf Atomen.
Zeigt die Hydroxy-Gruppe des ersten C-Atoms zur Ether-Brücke hin, handelt es sich um die $\beta$-Form.
LösungMonosaccharide, die in Form eines fünfgliedrigen Rings vorliegen, leiten sich strukturell vom Furan ab. Sie werden daher als Furanosen bezeichnet. Die entsprechenden fünfgliedrigen Ringe der Pentose Ribose werden daher als Ribofuranosen bezeichnet.
Analog werden Monosaccharide, die in Form eines sechsgliedrigen Rings vorliegen, als Pyranosen bezeichnet. Diese leiten sich strukturell vom Pyran ab. Die entsprechenden Formen der Ribose werden daher als Ribopyranose bezeichnet.In den Furanosen und Pyranosen der Ribose ist das erste C-Atom des Rings das anomere C-Atom. Es ist ein chirales C-Atom und kann daher in S- und in R-Form vorliegen. Die beiden Stereoisomere werden mit $\alpha$ und $\beta$ bezeichnet. In der Harworth-Schreibweise zeigen die Hydroxy-Gruppen am anomeren C-Atom bei den $\alpha$-Anomeren nach unten und bei den $\beta$-Anomeren nach oben.
-
Ermittle die Ringform der D-Xylose.
TippsZähle die C-Atome in der Kette und im Ring!
FLOH-Regel beachten!
Die Hydroxy-Gruppe des zweiten C-Atoms muss nach unten weisen.
LösungIn der Fischer-Projektion der offenkettigen Form der Xylose befinden sich die Hydroxy-Gruppen am zweiten und vierten Kohlenstoffatom auf der rechten Seite, die Hydroxy-Gruppe am dritten Kohlenstoffatom zeigt nach links.
In Ringform bleiben im Fall der Furanose die Hydroxy-Gruppen am zweiten und dritten Kohlenstoffatom bestehen. Sie befinden sich in der üblichen Harworth-Darstellung im Ring unten. Nach der FLOH-Regel muss die Hydroxy-Gruppe am rechten Kohlenstoffatom, also am zweiten Kohlenstoffatom im Ring, nach unten zeigen. Die Hydroxy-Gruppe am benachbarten dritten Kohlenstoffatom muss jedoch nach oben zeigen.
Liegt die Verbindung als Pyranose vor, sind alle drei Hydroxy-Gruppen vorhanden. Rechts vom Sauerstoff-Atom liegt das erste C-Atom, das zweite ist unten rechts im Ring zu finden. Die OH-Gruppe muss nach unten zeigen. Beim benachbarten C-Atom zeigt sie nach oben, da es sich um das dritte Kohlenstoffatom handelt. Die OH-Gruppe am Kohlenstoffatom, das die linke Spitze des Sechsecks bildet, zeigt wiederum nach unten. -
Ordne den Furanosen die entsprechenden Pyranosen zu.
TippsIn der korrekten Harworth-Schreibweise ist bei einem Sechsring das Sauerstoffatom oben rechts! Ist das nicht der Fall, musst du das Molekül in die richtige Position drehen.
Achte auf die richtige Position der Hydroxymethylgruppe.
LösungNicht nur die Aldopentosen sind in der Lage, durch Ringschluss fünfgliedrige oder sechsgliedrige Ringsysteme zu bilden. Auch Aldohexosen und Ketohexosen sind dazu in der Lage.
Betrachtet man die Zucker in der Furanose-Form, so ist bei allen Pentosen und Hexosen am Kohlenstoffatom links des Sauerstoffatoms ein organischer Rest gebunden, der nicht Teil des Ringes ist. Dieser besteht bei Pentosen aus einem Kohlenstoffatom mit einer Hydroxy-Gruppe, ebenso ist es auch bei Ketohexosen. Bei der Bildung einer Pyranose des entsprechenden Zuckers bildet sich ein Halbacetal unter Beteiligung dieser Hydroxy-Gruppe. Die funktionellen Gruppen an den Kohlenstoffatomen zwei bis vier sind also identisch zur entsprechenden Furanose, am ersten Kohlenstoffatom kann es zu einer anderen Konformation kommen.Bei Aldohexosen ist in der Furanose-Form der organische Rest, der nicht in den Ring eingebunden ist, etwas länger. Er besteht aus einem $-CHOH-CH_2OH$-Fragment. Es liegen also vier Kohlenstoffatome im Ring, zwei bilden den organischen Rest. Formt sich diese Verbindung zur entsprechenden Pyranose, so erfolgt der Ringschluss zwischen der ersten Hydroxy-Gruppe des organischen Restes und der Aldehydgruppe.
-
Benenne die Verbindungen.
TippsFuran und Pyran weisen Doppelbindungen auf.
Pyran bildet einen Ring aus sechs Atomen.
LösungFuran und Pyran sind einfache heterocyclische Verbindungen. Pyran leitet sich vom Benzol-Ring ab, indem ein Kohlenstoffatom durch ein Sauerstoffatom ersetzt wird. Dadurch fällt eine der Doppelbindungen weg, es verbleiben zwei Doppelbindungen.
Durch Hydrierung der Doppelbindungen erhält man ein sechsgliedriges Ringsystem ohne Doppelbindungen. Dieses enthält vier Wasserstoffatome mehr als das Pyran, daher wird diese Verbindung als Tetrahydropyran bezeichnet. Sie bildet das Grundgerüst für alle Pyranosen.Furan ist ein Fünfring, der ebenfalls ein Sauerstoffatom und zwei Doppelbindungen enthält. Nach den Regeln von Hückel handelt es sich damit um eine aromatische Verbindung.
-
Erschließe die Namen der Pentosen.
TippsLösungBei der Benennung von Monosacchariden gibt es immer vier Fragen zu beantworten:
- Handelt es sich um die offenkettige Form, eine Pyranose oder eine Furanose?
- Handelt es sich um das $\alpha$- oder $\beta$-Isomer?
- Handelt es sich um das D- oder L-Isomer?
- Um welchen Zucker handelt es sich?

Grundbaustoffe der Nahrung – Kohlenhydrate, Eiweiße und Fette

Monosaccharide

Glucose und Fructose

Glucose – Kette oder Ring?

Monosaccharide mit 3 bis 6 C-Atomen

Monosaccharide – Nomenklatur und Stereochemie

Monosaccharide – Eigenschaften und Reaktionen

Pyranosen und Furanosen

D-Ribopyranose und D-Ribofuranose

Sesselform-Schreibweise der Pyranosen

Halbacetal- und Acetalbildung

Disaccharide

Disaccharide – Besondere Glykoside

Reduzierende und nichtreduzierende Disaccharide

Saccharose und Maltose

Polysaccharide

Polysaccharide – Cellulose, Stärke, Glykogen

Stärke und Cellulose

Nachweis von Kohlenhydraten

Moleküldarstellungen von Kohlenhydraten

Zuckerderivate
Glykoside und glykosidische Bindung

Glykolipide und Glykoproteine

Hyaluronsäure, Heparin, Chitin
9.178
sofaheld-Level
6.600
vorgefertigte
Vokabeln
8.108
Lernvideos
37.100
Übungen
33.418
Arbeitsblätter
24h
Hilfe von Lehrkräften

Inhalte für alle Fächer und Klassenstufen.
Von Expert*innen erstellt und angepasst an die Lehrpläne der Bundesländer.
Testphase jederzeit online beenden
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- Fraktionierte Destillation Von Erdöl
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung
- Fermentation




 5 Minuten verstehen
5 Minuten verstehen
 5 Minuten üben
5 Minuten üben
 2 Minuten Fragen stellen
2 Minuten Fragen stellen

 Bereit für eine echte Prüfung?
Bereit für eine echte Prüfung?









Hallo Herr Otto. Bei der Schließung der D-Ribose zu einem 6 Ring fällt, Ihrer Zeichnung ab Minute 5:34 zu entnehmen, ein Wasserstoff Atom am 5ten C-Atom weg, also an der Ch2OH Gruppe. Wer kriegt, oder wer erhält dieses "Abgefallene" Wasserstoffatom?