Zuckerderivate
- Zuckerderivate – von Monosacchariden abgeleitete Substanzen
- Vitamin C – ein wichtiges Zuckerderivat
- Zuckeralkohole – ein weiteres wichtiges Zuckerderivat
- Struktur und Eigenschaften
- Verwendung in der Ernährung – Zuckeraustauschstoffe
- Charakteristische Nachweise der Zuckeralkohole
- Zuckeralkohole und ihre Wirkung auf den Stoffwechsel
- Zusammenfassung zum Thema Zuckerderivate
- Häufig gestellte Fragen zum Thema Zuckerderivate
in nur 12 Minuten? Du willst ganz einfach ein neues
Thema lernen in nur 12 Minuten?
-
 5 Minuten verstehen
5 Minuten verstehen
Unsere Videos erklären Ihrem Kind Themen anschaulich und verständlich.
92%der Schüler*innen hilft sofatutor beim selbstständigen Lernen. -
 5 Minuten üben
5 Minuten üben
Mit Übungen und Lernspielen festigt Ihr Kind das neue Wissen spielerisch.
93%der Schüler*innen haben ihre Noten in mindestens einem Fach verbessert. -
 2 Minuten Fragen stellen
2 Minuten Fragen stellen
Hat Ihr Kind Fragen, kann es diese im Chat oder in der Fragenbox stellen.
94%der Schüler*innen hilft sofatutor beim Verstehen von Unterrichtsinhalten.
Lerntext zum Thema Zuckerderivate
Zuckerderivate – von Monosacchariden abgeleitete Substanzen
Zuckerderivate sind eine wichtige Gruppe von Substanzen, die sich aus Monosacchariden ableiten. Monosaccharide, auch Einfachzucker genannt, sind die Bausteine vieler komplexer Kohlenhydrate. Durch chemische Veränderungen dieser Monosaccharide entstehen verschiedene Derivate mit spezifischen Funktionen und Anwendungen. Ein bekanntes Beispiel eines Zuckerderivats ist Vitamin C, das chemisch als Ascorbinsäure bezeichnet wird. In diesem Text werden die wichtigsten Zuckerderivate vorgestellt, ihre chemischen Eigenschaften erläutert und ihre Anwendung in der Ernährung, vor allem im Zusammenhang mit Diabetes und Light-Produkten, diskutiert.
Vitamin C – ein wichtiges Zuckerderivat
Vitamin C, chemisch L-Ascorbinsäure, ist ein prominentes Beispiel für ein Zuckerderivat, das aus der Struktur von D-Glucose abgeleitet wird. Die Verbindung gehört zur Gruppe der Lactone, einer Unterkategorie der Zuckerderivate, die durch die intramolekulare Bildung eines Esters entstehen. Vitamin C leitet sich von der Struktur der D-Glucose ab, wobei die Hydroxylgruppen teilweise oxidiert und rearrangiert werden, um die charakteristische Lactonstruktur der Ascorbinsäure zu bilden.
Die Summenformel von Vitamin C lautet $\ce{C6H8O6}$, ähnlich der D-Glucose, was die enge strukturelle Verwandtschaft zeigt.
Die Strukturformel von Vitamin C ist im Folgenden dargestellt.

Bedarf und Überdosierung
Vitamin C spielt eine zentrale Rolle als Radikalfänger, da es reaktive Sauerstoffspezies neutralisiert und somit Zellen vor oxidativen Schäden schützt. Es ist auch wichtig für die Kollagensynthese, die Immunfunktion und die Wundheilung. Der tägliche Bedarf an Vitamin C beträgt für Erwachsene etwa 90 mg, jedoch können erhöhte Mengen bei Stress, Infektionen oder bei Raucherinnen und Rauchern notwendig sein. Eine Überdosierung von Vitamin C ist selten, da es ein wasserlösliches Vitamin ist, das der Körper leicht über den Urin ausscheidet. Hohe Dosen, insbesondere über 2 000 mg pro Tag, können jedoch zu Magenbeschwerden, Durchfall und in seltenen Fällen zu Nierensteinen führen.
Chemische Eigenschaften von Vitamin C und seine Acidität
Die Ascorbinsäure zeigt aufgrund ihrer Struktur eine schwache Säureeigenschaft. Die Säurestärke lässt sich auf die Dissoziation der Hydroxylgruppe an der C3-Position zurückführen, wodurch das Anion stabilisiert wird. Der pKa-Wert von Ascorbinsäure liegt bei etwa 4,2, daher ist die Verbindung als schwache Säure einzuordnen. Ihre Fähigkeit, Protonen abzugeben, macht sie in biochemischen Systemen zu einem wichtigen Reduktionsmittel, das Elektronen überträgt und so zur Neutralisierung freier Radikale beiträgt. Neben der Rolle als Radikalfänger hat Vitamin C weitere Funktionen, wie z. B. die Reduktion von Metallionen und die Förderung der Eisenaufnahme im menschlichen Körper. Diese vielseitigen Eigenschaften machen Ascorbinsäure zu einem essenziellen Bestandteil der menschlichen Ernährung.
Zuckeralkohole – ein weiteres wichtiges Zuckerderivat
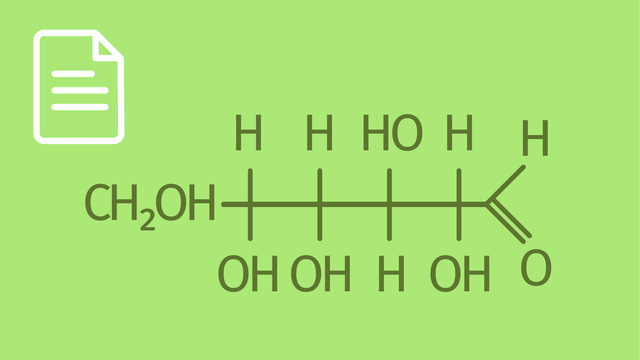
Zuckeralkohole, auch Polyole genannt, sind eine Gruppe von Zuckerderivaten, die durch die Reduktion der Carbonylgruppe eines Monosaccharids entstehen. Dieser Prozess wandelt die Aldehyd- oder Ketogruppe eines Zuckers in eine Hydroxylgruppe um, was zur Bildung eines Zuckeralkohols führt. Ein bekanntes Beispiel ist die Umwandlung von D-Glucose zu Sorbitol, einem weitverbreiteten Zuckeralkohol. Eine Darstellung von Sorbitol siehst du hier:

Struktur und Eigenschaften
Zuckeralkohole besitzen ähnliche Strukturen wie ihre zugrunde liegenden Zucker, jedoch fehlt ihnen die Carbonylgruppe, die für Monosaccharide typisch ist. Aufgrund ihrer modifizierten Struktur zeigen sie andere physikalische und chemische Eigenschaften. Zuckeralkohole sind z. B. nicht kariogen, dies bedeutet, dass sie das Risiko für Karies nicht erhöhen, da sie von Mundbakterien nicht zu Säuren abgebaut werden können. Die reduzierende Wirkung von Zuckeralkoholen hängt von ihrer Fähigkeit ab, in basischen Lösungen mit schwachen Oxidationsmitteln zu reagieren. Diese reduzierende Eigenschaft von Zuckeralkoholen kann mithilfe des Fehling- oder Tollens-Reagenz nachgewiesen werden, wobei die Zuckeralkohole Kupfer- oder Silberionen reduzieren.
Verwendung in der Ernährung – Zuckeraustauschstoffe
Zuckeralkohole sind in der Nahrungsmittelindustrie als Zuckeraustauschstoffe sehr beliebt. Sie liefern zwar Kalorien, jedoch deutlich weniger als Haushaltszucker (Saccharose). Zudem haben sie nur einen geringen Einfluss auf den Blutzuckerspiegel, da sie langsamer und nur teilweise im Verdauungstrakt absorbiert werden. Dadurch sind sie besonders geeignet für Menschen mit Diabetes, da Zuckeralkohole den Blutzuckeranstieg nach dem Essen nicht so stark beeinflussen wie normale Zucker.
Zuckeralkohole wie Sorbitol, Mannitol und Xylitol finden sich in vielen Light-Produkten, wie kalorienreduzierten Süßigkeiten und Kaugummis. Daher sind sie auch für Menschen, die ihr Gewicht kontrollieren wollen, eine attraktive Alternative.
Charakteristische Nachweise der Zuckeralkohole
Ein wichtiger Nachweis für Zuckeralkohole ist der Test auf reduzierende Zucker, da Zuckeralkohole in alkalischen Lösungen durch Kupfer(II)-Ionen reduziert werden können. Bei der Verwendung des Fehling-Reagenzes wird die Lösung durch Zuckeralkohole von Blau zu Rot verfärbt, was auf die Bildung von Kupfer(I)-oxid hinweist. Ein weiterer Nachweis ist der Tollens-Test, bei dem die Silberionen in basischer Lösung zu metallischem Silber reduziert werden, das sich als Spiegel an der Reagenzglaswand absetzt.
Zuckeralkohole und ihre Wirkung auf den Stoffwechsel
Zuckeralkohole beeinflussen den Stoffwechsel anders als herkömmliche Zucker. Sie werden langsamer und unvollständiger aufgenommen, was zu einem geringeren Insulinbedarf führt. Dies macht sie besonders wertvoll in der Ernährung von Diabetikerinnen und Diabetikern. Da Zuckeralkohole nicht vollständig verdaut werden, gelangen sie in den Dickdarm, wo sie von Bakterien fermentiert werden können. Dieser Prozess kann jedoch in hohen Mengen zu Blähungen oder Durchfall führen, weshalb die empfohlene tägliche Höchstmenge in Lebensmitteln oft angegeben wird. Xylitol ist ein Zuckeralkohol, der besonders bekannt ist für seine Verwendung in Zahnpflegeprodukten und Kaugummis. Es wirkt antikariogen, da es das Wachstum von Karies verursachenden Bakterien hemmt. Zudem stimuliert es die Speichelproduktion, was zur Remineralisierung der Zähne beiträgt.
Zusammenfassung zum Thema Zuckerderivate
- Zuckerderivate wie Vitamin C und Zuckeralkohole spielen in der Chemie und Ernährung eine bedeutende Rolle.
- Vitamin C ist ein essenzielles Zuckerderivat, das als Antioxidans und Radikalfänger im Körper wirkt und zahlreiche biologische Funktionen erfüllt.
- Zuckeralkohole wie Sorbitol und Xylitol sind wertvolle Zuckeraustauschstoffe, die vor allem in der Ernährung von Diabetikerinnen und Diabetikern und in Light-Produkten Anwendung finden.
- Die chemischen Eigenschaften dieser Derivate, wie die Säurestärke von Ascorbinsäure oder die reduzierende Wirkung von Zuckeralkoholen, ermöglichen zahlreiche Nachweismethoden und erklären ihre vielfältigen Funktionen. In der modernen Ernährung bieten Zuckeralkohole eine Möglichkeit, Kalorien zu reduzieren und gleichzeitig den Genuss von Süßigkeiten zu ermöglichen, ohne den Blutzuckerspiegel stark zu beeinflussen.
- Zuckerderivate sind somit nicht nur chemisch interessant, sondern haben auch praktische Anwendungen, die sie zu wichtigen Substanzen in der Lebensmittelindustrie und Medizin machen.
Häufig gestellte Fragen zum Thema Zuckerderivate
Zuckerderivate Übung
-
Beschreibe den Grund für die saure Eigenschaft des Vitamin C.
TippsDie Nummerierung der Kohlenstoffatome beginnt rechts vom Ring-Sauerstoffatom und verläuft im Uhrzeigersinn.
LösungHydroxygruppen geben ihr $H^+$-Ion nur unter bestimmten Bedingungen ab. Alkohole sind daher in der Regel kaum sauer. Dafür ist eine Stabilisierung des Anions notwendig. Dies geschieht dadurch, dass die negative Ladung auf mehrere Atome verteilt wird. Bei der Carbonsäuregruppe verteilt sich die negative Ladung beispielsweise auf die beiden Sauerstoffatome der funktionellen Gruppe.
Erkennen kann man dies daran, dass man mehrere mesomere Grenzstrukturen aufstellen kann. Daher bezeichnet man diese Art der Stabilisierung auch als Mesomerie-Stabilisierung.
Im Fall der Ascorbinsäure sind die beiden Sauerstoffatome, die die negative Ladung tragen, mehrere Kohlenstoffatome von einander entfernt. Dennoch gelingt es, die zwei oben dargestellten mesomeren Grenzstrukturen aufzustellen. Dies liegt daran, dass zwischen den beiden Sauerstoffatomen ein System an konjugierten Doppelbindungen besteht. Durch „Umklappen“ der Doppelbindungen geht die eine Darstellung des Moleküls in die andere über.
-
Gib alle chiralen Kohlenstoffatome der Ascorbinsäure an.
TippsChirale C-Atome haben vier unterschiedliche Substituenten.
LösungBei Ascorbinsäure handelt es sich um ein Derivat des $\gamma-$Lactons. Am vierten C-Atom des Lacton-Rings ist eine Seitenkette gebunden, daher ist dieses Kohlenstoffatom chiral. Es trägt vier unterschiedliche Substituenten: Sauerstoff, den Lacton-Ring, das Wasserstoffatom und die Seitenkette. Es liegt in S-Konfiguration vor. Auch das fünfte C-Atom ist chiral: Es trägt den Lacton-Ring, eine $OH-$Gruppe, eine $CH_2OH-$Gruppe und ein Wasserstoffatom. Dieses C-Atom liegt in R-Konfiguration vor.
Alle übrigen Kohlenstoffatome sind nicht chiral, da sie über Doppelbindungen mit ihren Nachbaratomen verbunden sind.
-
Erläutere die Wirkung der Ascorbinsäure als Radikalfänger.
TippsRadikale erkennst du an dem Punkt, der ein ungepaartes Elektron symbolisiert.
LösungWie beim Ascorbat liegt auch beim Radikalfang eine Mesomeriestabilisierung vor. Die Eigenschaft als Radikalfänger verdankt die Ascorbinsäure der Stabilisierung der Semihydroascorbinsäure durch den Mesomerie-Effekt. Es lassen sich zwei mesomere Grenzstrukturen formulieren. Bei der zweiten mesomeren Grenzstruktur ist das Sauerstoff-Radikal an der Stelle der Carbonyl-Funktion.
Da das Semidehydroascorbinsäure-Radikal stabilisiert wird, liegt das Gleichgewicht der Reaktion auf der rechten Seite. Das Semidehydroascorbinsäure-Radikal reagiert leicht mit weiteren Radikalen weiter zur Dehydroascorbinsäure. Das dargestellte Diradikal ist ein sehr instabiler Übergangszustand, der schnell zur Dehydroascorbinsäure reagiert.
Die Endiol-Gruppe mit benachbarter Carbonyl-Funktion verursacht also die ungewöhnlich gute Wirkung als Reduktionsmittel.
-
Analysiere die Synthese von L-Ascorbinsäure aus D-Glucose.
TippsDie Konformation des letzten chiralen C-Atoms in der Fischer-Projektion entscheidet über D- oder L-Konformation eines Monosaccharids.
Steht die $OH-$Gruppe rechts, handelt es sich um die D-Form.
LösungDie Synthese von Ascorbinsäure aus Glucose ist ein komplexer Mechanismus, der viele Schritte umfasst und auf Katalysatoren wie zum Beispiel Enzyme angewiesen ist. Daher ist der Mechanismus hier nur stark vereinfacht und schematisch wiedergegeben.
Durch Oxidation der D-Glucose am sechsten C-Atom der Kette erhhält man die D-Glucoronsäure. Bei diesem Schritt wird die Konformation des Moleküls nicht verändert.
Im zweiten Schritt kommt es zur Reduktion der Aldehyd-Gruppe am $C^1$ zu einem primären Alkohol. Nach den Regeln der Fischer-Projektion muss das Molekül nun um 180° in der Papierebene gedreht werden, da das Kohlenstoffatom der Carbonsäuregruppe nun das am stärksten oxidierte Kohlenstoffatom der Kette ist. Folglich ist das der Schritt, in dem der Übergang von der D- in die L-Konformation stattfindet. Dies ist daran zu erkennen, dass die $OH-$Gruppe am letzten chiralen C-Atom bei der L-Gulonsäure auf der linken Seite der Fischer-Projektion steht.
Weder bei der folgenden Dehydratisierung noch bei der Oxidation und Enol-Bildung wird die Konformation des Moleküls verändert.
-
Schildere den Vitamin-C-Bedarf des Menschen.
TippsDer wissenschaftliche Name von Vitamin C, Ascorbinsäure, leitet sich vom Namen der Mangelerkrankung ab.
LösungLange vor der Entdeckung des Vitamin C war die Mangelerkrankung Skorbut bekannt. Bei unzureichender Ernährung mit frischen Lebensmitteln wie Obst und Gemüse ereilte viele Seefahrer das Schicksal, an Skorbut zu erkranken. Dabei kommt es zu einer Reihe von Symptomen wie Zahnfleischbluten, Schwindel, Gelenkschmerzen und Anfälligkeit für Infektionskrankheiten. Bei anstrengender Arbeit kann Skorbut zum Tod durch Herzschädigung führen.
Skorbut lässt sich einfach heilen, indem etwa 100 mg Vitamin C am Tag aufgenommen werden. Dies ist durch normale Ernährung gewährleistet und wird nur unter ungewöhnlichen Umständen nicht erreicht.
Eine Überdosierung tritt erst bei großen Mengen auf. Dies kann mit normaler Kost nicht erreicht werden. Um die erforderlichen 6 g Vitamin C aufzunehmen, müsstest du etwa 6 kg Obst am Tag essen.
-
Leite den systematischen Namen von L-Ascorbinsäure her.
TippsDer in eckigen Klammern geschriebene Teil des Namens ist die Seitenkette. Diese hat eine eigene Nummerierung.
Ketone haben die Endung -on.
LösungDem systematischen Namen vorangestellt ist die Konformation des fünften Kohlenstoffatoms im Furan-Ring. Dies ist das Kohlenstoff-Atom, das die Seitenkette trägt. Die Bezeichnung (5R) bezieht sich also auf dieses Kohlenstoffatom. Anschließend folgt die Seitenkette, die an das fünfte Kohlenstoffatom gebunden ist. Dies ist mit den eckigen Klammern gekennzeichnet. Auch dieser Name beginnt mit der Konformation des chiralen C-Atoms am Beginn der Kette, dieses hat eine S-Konformation. Die Seitenkette ist der 1,2-Dihydroxyethyl-Rest.
Es folgen die funktionellen Gruppen am Furan-Ring. Dies sind die beiden Hydroxy-Gruppen in Position drei und vier (3,4-dihydroxy) sowie das Wasserstoffatom in Position fünf (5-hydro). Das ringförmige Grundgerüst wird mit Furan bezeichnet. Die Keto-Gruppe in Position zwei des Rings schließlich wird mit -2-on gekennzeichnet. Damit ist das Molekül eindeutig beschrieben und lässt sich anhand des Namens zeichnen.

Grundbaustoffe der Nahrung – Kohlenhydrate, Eiweiße und Fette

Monosaccharide

Glucose und Fructose

Glucose – Kette oder Ring?

Monosaccharide mit 3 bis 6 C-Atomen

Monosaccharide – Nomenklatur und Stereochemie

Monosaccharide – Eigenschaften und Reaktionen

Pyranosen und Furanosen

D-Ribopyranose und D-Ribofuranose

Sesselform-Schreibweise der Pyranosen

Halbacetal- und Acetalbildung

Disaccharide

Disaccharide – Besondere Glykoside

Reduzierende und nichtreduzierende Disaccharide

Saccharose und Maltose

Polysaccharide

Polysaccharide – Cellulose, Stärke, Glykogen

Stärke und Cellulose

Nachweis von Kohlenhydraten

Moleküldarstellungen von Kohlenhydraten

Zuckerderivate
Glykoside und glykosidische Bindung

Glykolipide und Glykoproteine

Hyaluronsäure, Heparin, Chitin
9.178
sofaheld-Level
6.600
vorgefertigte
Vokabeln
8.108
Lernvideos
37.100
Übungen
33.418
Arbeitsblätter
24h
Hilfe von Lehrkräften

Inhalte für alle Fächer und Klassenstufen.
Von Expert*innen erstellt und angepasst an die Lehrpläne der Bundesländer.
Testphase jederzeit online beenden
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- Fraktionierte Destillation Von Erdöl
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung
- Fermentation


 5 Minuten verstehen
5 Minuten verstehen
 5 Minuten üben
5 Minuten üben
 2 Minuten Fragen stellen
2 Minuten Fragen stellen

 Bereit für eine echte Prüfung?
Bereit für eine echte Prüfung?









