Glykoside und glykosidische Bindung
- Glykoside – der Haushaltszucker und die DNA haben eine Gemeinsamkeit
- Wiederholung: das Halbacetal
- Bildung von Glykosiden
in nur 12 Minuten? Du willst ganz einfach ein neues
Thema lernen in nur 12 Minuten?
-
 5 Minuten verstehen
5 Minuten verstehen
Unsere Videos erklären Ihrem Kind Themen anschaulich und verständlich.
92%der Schüler*innen hilft sofatutor beim selbstständigen Lernen. -
 5 Minuten üben
5 Minuten üben
Mit Übungen und Lernspielen festigt Ihr Kind das neue Wissen spielerisch.
93%der Schüler*innen haben ihre Noten in mindestens einem Fach verbessert. -
 2 Minuten Fragen stellen
2 Minuten Fragen stellen
Hat Ihr Kind Fragen, kann es diese im Chat oder in der Fragenbox stellen.
94%der Schüler*innen hilft sofatutor beim Verstehen von Unterrichtsinhalten.
Lerntext zum Thema Glykoside und glykosidische Bindung
Glykoside – der Haushaltszucker und die DNA haben eine Gemeinsamkeit
Wiederholung: das Halbacetal
Wenn ein Aldehyd und ein Alkohol miteinander reagieren, dann entsteht ein Halbacetal.
$\ce{\text{Aldehyd + Alkohol} -> \text{Halbacetal}}$
Charakteristisch für Halbacetale sind die Hydroxy- ($\ce{OH-}$) und die Alkoxygruppe ($\ce{OR-}$) an demselben Kohlenstoffatom.
In ihrer zyklischen Form liegen Aldosen, wie Glucose, als Halbacetale vor.
Bildung von Glykosiden
Wenn ein Halbacetal und ein Alkohol miteinander reagieren, dann entsteht ein Acetal. Dabei spaltet sich Wasser ab. Es findet also eine Kondensation des Alkohols statt. Genauer handelt es sich bei dieser Kondensationsreaktion um eine Veretherung.
$\ce{\text{Halbacetal + Alkohol} -> \text{Acetal} + H2O}$
Charakteristisch für Acetale sind die zwei Alkoxygruppen ($\ce{OR-}$) an demselben Kohlenstoffatom.
Wenn ein Halbacetal (z. B. ein Monosaccharid) mit einem Alkohol reagiert, entsteht ein (Voll-)Acetal, das man bei Zuckern als Glykosid bezeichnet.
$\ce{\text{Monosaccharid + Alkohol} -> \text{Glykosid} + H2O}$
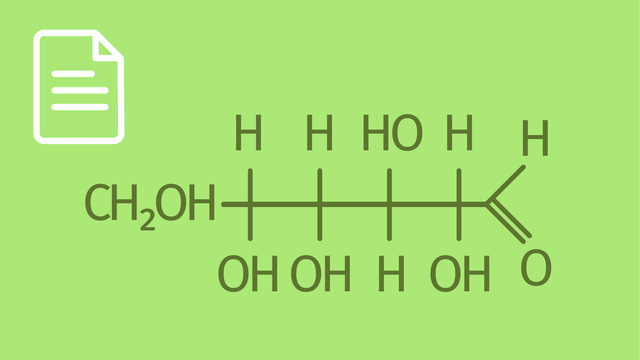
Wenn D-Glucopyranose zum Beispiel mit Methanol reagiert, entsteht Methyl-D-Glucopyranosid.
Monosaccharide besitzen ein Kohlenstoffatom, an dem vier verschiedene Reste (oder auch Substituenten) hängen. Dieses Kohlenstoffatom ist das sogenannte anomere Kohlenstoffatom. Die Reaktion zur Bildung des (Voll-)Acetals findet an der Hydroxygruppe dieses anomeren Kohlenstoffatoms statt.
Die Bindung zwischen dem anomeren Kohlenstoffatom des Monosaccharids und dem Sauerstoffatom des Alkohols heißt glykosidische Bindung.
Die anomeren Formen eines Monosaccharids unterscheiden sich in der Stellung der Hydroxygruppe am anomeren Kohlenstoffatom: Steht die Hydroxygruppe axial (unten) am C1-Atom, spricht man von der α-Form. Steht sie äquatorial (oben), handelt es sich um die β-Form.
Monosaccharide besitzen wie Alkohole auch Hydroxygruppen, sodass zwei Monosaccharide miteinander reagieren und ebenfalls glykosidische Bindungen bilden können. Zum Beispiel bilden Glucose und Fructose das Disaccharid Saccharose. Saccharose ist Haushaltszucker.
Die genaue chemische Bezeichnung für Saccharose ist α-D-Glucopyranosyl-(1-2)-β-D-fructofuranosid. In dem Namen wird deutlich, dass sich die glykosidische Bindung zwischen dem anomeren ${\text{C}}$1-Atom der α-D-Glucopyranose und dem ${\text{C}}$2-Atom der β-D-fructofuranose ausbildet. Daher spricht man bei dieser Bindung von einer α,β-1,2-glykosidischen Bindung.
Übrigens kann sich die glykosidische Bindung statt zwischen einem Sauerstoff- ($\ce{O}$) auch zwischen einem Stickstoff- ($\ce{N}$), Schwefel- ($\ce{S}$) oder Phosphoratom ($\ce{P}$) und dem anomeren Kohlenstoffatom ausbilden.
Glykosidische Bindungen mit Stickstoff ($\ce{N}$) befinden sich zum Beispiel in der DNA.
Eigenschaften von Glykosiden
Im Gegensatz zu den Monosacchariden sind Glykoside in der $\alpha$-Form stabiler als in der $\beta$-Form. Zwischen der $\alpha$- und der $\beta$-Form herrscht zudem kein anomeres Gleichgewicht.
Monosaccharide liegen in wässriger Lösung sowohl in der Ringform als auch in der offenkettigen Form vor. Vor allem in alkalischen Lösungen verschiebt sich das Gleichgewicht zur offenkettigen Form, sodass die Aldehydgruppe zugänglich ist und die Verbindung als reduzierend wirkt. Daher können Monosaccharide mit der Fehling-Probe nachgewiesen werden. Die Ringe der Glykoside hingegen können sich nicht öffnen. Der Grund dafür ist, dass das anomere C-Atom an der glykosidischen Bindung beteiligt ist. Aufgrund der geschlossenen Ringstruktur können Glykoside keine freie Aldehydgruppe bilden, die für die Reduktion von Fehling- oder Tollens-Reagenz notwendig ist. Glykoside sind also nicht reduzierend.
Beispiele und ihre biologische Bedeutung
Polysaccharide
Reagieren mehrere Monosaccharide miteinander und bilden glykosidische Bindungen aus, dann entstehen Polysaccharide. Polysaccharide gehören zu den Biopolymeren. Zum Beispiel sind Stärke und Cellulose Polysaccharide.
Die Stärke besteht aus α-D-Glucose-Einheiten, die zum Teil über α-1,4-glykosidische Bindungen und zum Teil über α-1,6-glykosidische Bindungen miteinander verknüpft sind.
Cellulose hingegen besteht aus β-D-Glucose-Einheiten, die über β-1,4-glykosidische Bindungen miteinander verknüpft sind.
Der Mensch kann Stärke verdauen, aber Cellulose nicht. Grund dafür ist, dass das Verdauungsenzym des Menschen für die Spaltung von α-glykosidischen Bindungen spezialisiert ist. Das Enzym heißt Amylase. Für den Abbau von Cellulose bräuchte der Mensch das Enzym Cellulase, das die β-glykosidischen Bindungen der Cellulose brechen können.
Glykoproteine
In Lebewesen kommen Proteine mit Zuckermolekülen gebunden vor. Das Zuckermolekül hängt dabei über eine glykosidische Bindung mit dem Peptid zusammen. Hierbei werden O-Glykoside und N-Glykoside unterschieden.
Zu den Glykoproteinen gehören zum Beispiel Hormone, Bestandteile des Immunsystems und Bestandteile der Zellmembran.
DNA
Die DNA ist eine Kette aus einzelnen sogenannten Nukleotiden. Solch ein Nukleotid setzt sich aus drei Bestandteilen zusammen, und zwar einem Monosaccharid, einer Phosphatgruppe und einer Base. Das Monosaccharid ist immer eine Desoxyribose. Die Desoxyribose ist eine Ribose, bei dem am zweiten Kohlenstoffatom ein Sauerstoffatom fehlt. In der DNA liegt eine N-glykosidische Bindung zwischen dem anomeren Kohlenstoffatom der Desoxyribose und dem Stickstoffatom der Nukleinbase vor.
Zusammenfassung – Glykoside und glykosidische Bindung
- Glykoside sind Acetale, die aus einem Monosaccharid und einem organischen Rest bestehen.
- Glykoside entstehen durch die Reaktion aus Monosacchariden mit anderen organischen Molekülen, die eine Hydroxygruppe besitzen.
- Die Bindung zwischen dem anomeren Kohlenstoffatom des Monosaccharids und dem Sauerstoffatom der Hydroxygruppe des organischen Rests heißt glykosidische Bindung.
- Im Molekül der Saccharose ist ein Glucosemolekül mit einem Fructosemolekül über eine α,β-1,2-glykosidische Bindung verbunden.
- Wichtige Glykoside sind Polysaccharide, Glykoproteine und die DNA.
Häufig gestellte Fragen zum Thema Glykoside und glykosidische Bindung
Glykoside und glykosidische Bindung Übung
-
Erkläre die Entstehung eines Glykosids.
TippsDie Glucose ist ein Halbacetal und reagiert mit einem Alkohol.
LösungMonosaccharide reagieren zusammen mit Alkoholen zu sogenannten Glykosiden. Als Reaktionsnebenprodukt entsteht Wasser. Die Reaktionsprodukte sind illustriert.
Das Kohlenstoffatom an der $OC{ H }_{ 3 }$ nennt man anomeres Kohlenstoffatom. Die glykosidische Bindung bildet sich nun zwischen diesem C-Atom und dem Sauerstoffatom des Alkohols aus. Es bildest sich eine $OC{ H }_{ 3 }$-Gruppe. Auch zwischen einem Zucker und einem Stickstoffatom kann sich eine glykosidische Bindung ausbilden. Die glykosidische Bindung ist eine sehr wichtige Bindung in der organischen Chemie.
-
Bestimme die Verbindungen, die an einer Acetalbildung beteiligt sind.
TippsEin Acetal entsteht aus der Reaktion von einem Aldehyd mit einem Alkohol.
LösungGlykoside entstehen aus der Reaktion von Zuckern mit Alkoholen oder Phenolen. Zucker sind formal Halbcacetale und Glykoside Vollacetale. Bei der Acetalbildung reagiert ein Aldehyd zusammen mit einem Alkohol zu einem Halbacetal, welches später mit einem weiteren Alkohol zu einem Vollacetal unter Wasserabspaltung reagiert. Analog dazu reagiert ein Monosaccharid zu einem Acetal.
Die glykosidische Bindung kann sich im Glykosid axial oder äquatorial aufstellen, wobei die axiale Position bevorzugt ist.
-
Erkläre den anomeren Effekt.
TippsHeteroatome sind nicht-Kohlenstoffatome und benötigen durch ihre Elektronegativität und freien Elektronenpaare Platz im Molekül.
LösungIm Molekül siehst du einen Cyclohexan-Ring mit einem Heteroatom im Ring, dem Sauerstoff. Ist nun ein weiteres Heteroatom am anomeren Kohlenstoffatom glykosidisch gebunden, kommt es zum anomeren Effekt. Durch diesen Effekt ordnet sich die OR-Gruppe nicht äquatorial an. Diese Anordnung würde man eigentlich vermuten, da sie sterisch günstiger ist, also mehr Platz bietet. Sie ordnet sich aber axial an. Erklären lässt sich das durch die Dipole der Heteroatome. Diese würden sich abstoßen, wenn sich sowohl das Sauerstoffatom des Ringes als auch das Sauerstoffatom der OR-Gruppe äquatorial befinden würden.
-
Ermittle die Verbindungen mit glykosidischer Bindung.
TippsAchte auf das anomere Kohlenstoffatom. Dieses zeigt dir an, wo die neue Bindung entstehen könnte und welche Moleküle eine glykosidische Bindung haben.
LösungDie glykosidische Bindung ist ein sehr wichtiger Bindungstyp in der Chemie. Eine glykosidische Bindung zeichnet sich stets dadurch aus, dass der anomere Kohlenstoff eine Bindung zu einem Heteroatom eingeht. Das muss nicht immer nur Sauerstoff sein. So bindet ein Zuckermolekül in der DNA zum Beispiel über eine glykosidische Bindung an ein Stickstoffatom in einer Nucleinbase. Auch die Bindung in einem Disaccharid, also die Bindung zwischen zwei Zuckermolekülen, ist eine glykosidische Bindung.
Ether besitzen dagegen keine glykosidische Bindung, da hier die anomere Bindung und das benachbarte Heteroatom fehlen.
-
Beschreibe die Eigenschaften von Glykosiden.
TippsEin chemisches Gleichgewicht liegt vor, wenn sowohl eine Hin- als auch eine Rückreaktion stattfinden.
Eine glykosidische Bindung ist nicht auf ein Sauerstoffatom beschränkt.
LösungGlykoside haben eine sogenannte glykosidische Bindung, das heißt die $OC{ H }_{ 3 }$-Bindung kann sich in der Sesselform sowohl axial (alpha-Stellung) oder äquatorial (beta-Stellung) anordnen. Bis hierhin sollten die Parallelen zu den Monosacchariden erkannt werden. Jedoch gilt hier genau das umgekehrte Prinzip, da bei Glykosiden die axiale alpha-Position bevorzugt ist. Ebenfalls liegt zwischen beiden Anomeren kein chemisches Gleichgewicht vor. Es gibt also keine Reaktion von alpha zu beta und umgekehrt, welche permanent stattfindet. Ebenfalls lassen sich Glykoside nicht mehr von Tollens-Reagenz oder Fehlinglösung oxidieren, da sie im Gegensatz zu Monosacchariden keine Reduktionsmittel sind. Auch kann die bereits erwähnte glykosidische Bindung anstatt des Sauerstoffs ein Stickstoffatom enthalten.
-
Bestimme die Reagenzien, die ein Monosaccharid von einem Glykosid unterscheiden können.
TippsÜberlege, welche Probe den Unterschied deutlich machen könnte.
Die Tollens-Probe und der Fehlingsche Nachweis dienen als Zuckernachweise.
LösungWichtig für die Unterscheidung eines reinen Monosaccharids oder eines Glykosids ist die Tatsache, dass Monosaccharide sich einfach oxidieren lassen. Mit den aufgeführten Materialen (Silbernitrat, Ammoniak) und dem Monosaccharid kann nun die sogenannte Tollens-Probe durchgeführt werden. Hierbei wird die Aldehyd-Gruppe des Monosaccharids im basischen Milieu zu einer Carbonsäure oxidiert und reines Silber fällt aus. Ist in der Probe also ein Zucker enthalten, siehst du nach Erwärmung einen Silberspiegel am Reagenzglas. Bleibt der Silberspiegel aus, enthält die Probe des Beispiels ein Glykosid.
$R-CHO + 2~ [Ag(NH_3)_2]^+ + 2~OH^- \rightarrow R-COOH + 2~Ag + 4~NH_3 +H_2O$

Grundbaustoffe der Nahrung – Kohlenhydrate, Eiweiße und Fette

Monosaccharide

Glucose und Fructose

Glucose – Kette oder Ring?

Monosaccharide mit 3 bis 6 C-Atomen

Monosaccharide – Nomenklatur und Stereochemie

Monosaccharide – Eigenschaften und Reaktionen

Pyranosen und Furanosen

D-Ribopyranose und D-Ribofuranose

Sesselform-Schreibweise der Pyranosen

Halbacetal- und Acetalbildung

Disaccharide

Disaccharide – Besondere Glykoside

Reduzierende und nichtreduzierende Disaccharide

Saccharose und Maltose

Polysaccharide

Polysaccharide – Cellulose, Stärke, Glykogen

Stärke und Cellulose

Nachweis von Kohlenhydraten

Moleküldarstellungen von Kohlenhydraten

Zuckerderivate
Glykoside und glykosidische Bindung

Glykolipide und Glykoproteine

Hyaluronsäure, Heparin, Chitin
9.213
sofaheld-Level
6.600
vorgefertigte
Vokabeln
8.120
Lernvideos
38.596
Übungen
33.424
Arbeitsblätter
24h
Hilfe von Lehrkräften

Inhalte für alle Fächer und Klassenstufen.
Von Expert*innen erstellt und angepasst an die Lehrpläne der Bundesländer.
Testphase jederzeit online beenden
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- Fraktionierte Destillation Von Erdöl
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung
- Fermentation


 5 Minuten verstehen
5 Minuten verstehen
 5 Minuten üben
5 Minuten üben
 2 Minuten Fragen stellen
2 Minuten Fragen stellen

 Bereit für eine echte Prüfung?
Bereit für eine echte Prüfung?


















